1、填空题 (15分)蓝铜矿主要含2CuCO3·Cu(OH)2,还含有少量Fe、Si的化合物,工业上以蓝铜矿为原料制备Cu及CaCO3,方法有多种。
(1)蓝铜矿与焦炭加热可以生成铜、二氧化碳和水,写出该反应的化学方程式。______________________________________________________________。
具体方法步骤如下:?
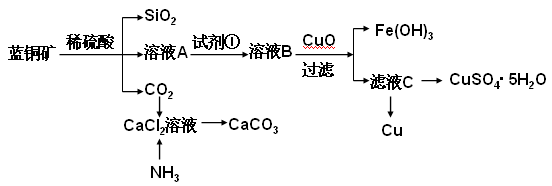
请回答下列问题:
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:检验溶液A中含有Fe2+的最佳试剂为?(填代号),实验步骤中试剂①为?(填代号)。
a.KMnO4? b.(NH4) 2S? c.H2O2? d.KSCN
(3)由溶液C获得CuSO4·5H2O,需要经过加热蒸发,冷却结晶、过滤等操作,加热蒸发至? ___________________时停止加热。玻璃棒在整个操作中的作用是? ________________?。
(4)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)?(填化学式)。若实验过程中有氨气逸出、应选用下列?装置吸收尾气(填代号)。
(5)从溶液C中获得Cu的方法有?(写出两种不同方法)。
(6)用惰性电极电解硫酸铜溶液一段时间后,加入2molCu(OH)2固体使硫酸铜溶液复原(复原是指溶液溶质成分及浓度与原来完全相同),则此电解过程中共转移电子?mol。
参考答案:(1)2[2CuCO3·Cu(OH)2]+3C 6Cu+7CO2↑+2 H2O (3分)?
6Cu+7CO2↑+2 H2O (3分)?
(2)a? c?(2分,各1分)?(3)有少量晶膜出现时(有少量晶体出现也可)(2分)引流、搅拌(2分)?(4)NH3(1分)? b?(1分)?(5)加入活泼金属Fe(或者写具体能制出Cu的其它金属也可)、用惰性电极电解硫酸铜溶液。?(2分)?(6) 8?(2分)
本题解析:略
本题难度:一般
2、实验题
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:
SO2+2NaOH==?________________________。
(2)反应Cl2+Na2SO3+2NaOH===2NaCl+Na2SO4+H2O中的还原剂为__________。
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-。
请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响)
①提出合理假设。
假设1:只存在SO32-;
假设2:既不存在SO32-,也不存在ClO-;
假设3:____________。
②设计实验方案,进行实验。请在表格中写出实验步骤以及预期现象和结论。限选实验试剂:3?mol/L?H2SO4、1?mol/L?NaOH、0.01?mol/L?KMnO4、淀粉-KI溶液、紫色石蕊试液。

参考答案:(1)Na2SO3+H2O
(2)Na2S O3
O3
(3)①SO32-、ClO-
②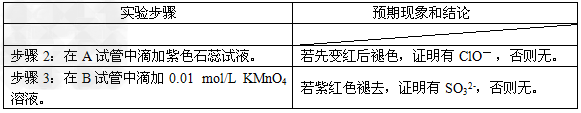
本题解析:
本题难度:一般
3、简答题 某同学按下图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液.请回答下列问题.
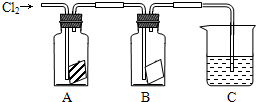
(1)通入Cl2一段时间后,A、B装置中,红色纸条的现象和结论为:
| 装置 | 现象 | 结论
A
______ |
潮湿的氯气______(填能或不能)使红色纸条褪色,因为反应生成的______具有漂白性
B
______
|
(2)C装置的作用是______
写出装置C中反应的化学方程式:______.
参考答案:(1)A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,则氯气不能使A中纸条褪色,而B中生成HClO,所以纸条褪色,则A中没有明显现象,B中褪色,因B中生成的HClO具有漂白性,
故答案为:装置现象结论A
无明显现象
能;HClOB
纸条褪色(2)氯气有毒,不能排放在空气中,利用NaOH溶液吸收,所以C的作用为除去多余的Cl2气,防止污染环境,发生的反应为2NaOH+Cl2=NaCl+NaClO+H2O,
故答案为:除去多余的Cl2气,防止污染环境;2NaOH+Cl2=NaCl+NaClO+H2O.
本题解析:
本题难度:简单
4、实验题 某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。 ?
⑴提出假设?①该反应的气体产物是CO2。?②该反应的气体产物是CO。③该反应的气体产物是__________。?
设计方案?如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。

⑵查阅资料氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。请写出该反应的离子方程式:______________。?
⑶实验步骤 ?
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁、2.00g碳粉混均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水(足量)变浑浊;
④待反应结束,再缓缓通入一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g;
⑤过滤出石灰水中的沉淀,洗涤、烘干后称得质量为2.00g。步骤②、④中都分别通入N2,其作用分别为_____________。
⑷数据处理试根据实验数据分析,写出该实验中氧化铁与碳发生反应的化学方程式:________________________。
参考答案:⑴CO2、CO的混合物
⑵NH4++NO2-?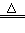 N2↑+2H2O
N2↑+2H2O
⑶步骤②中是为了排尽空气,步骤④是为了赶出所有的CO2,确保完全吸收
⑷2C+Fe2O3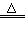 2Fe+CO↑+CO2↑
2Fe+CO↑+CO2↑
本题解析:
本题难度:一般
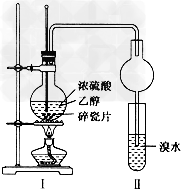
5、实验题 某化学兴趣小组用下图所示装置进行探究实验。以验证产物中有乙烯生成且乙烯具有不饱和性。当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色。
(1)写出该实验中生成乙烯的化学方程式______________
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是____________
A.乙烯与溴水易发生取代反应 ?
B.使溴水褪色的反应,未必是加成反应 ?
C.使溴水褪色的物质,未必是乙烯 ?
D.浓硫酸氧化乙醇生成乙醛,也会使溴水褪色
(3)乙同学经过细致观察后认为试管中另一现象可证明反应中有乙烯生成,这个现象是_______________________。为验证这一反应是加成而不是取代,可用pH试纸来测试反应后溶液的酸性,理由是____________________。
(4)丙同学对上述实验装置进行了改进,在I和Ⅱ之间增加如下图所示装置,则A中的试剂应为______________,其作用是_____________,B中的试剂为____________________
(5)处理上述实验后烧瓶中废液的正确方法是__________
A.废液经冷却后倒入下水道中?
B.废液经冷却后倒入空废液缸中
C.将水加入烧瓶中稀释后倒入废液缸
参考答案:(1)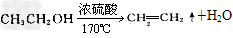
(2)BC
(3)液体分层,油状液体在下;若发生取代反应则生成HBr,水溶液的pH明显减小,若发生加成反应,水溶液的pH将增大
(4)NaOH溶液;除去SO2气体;品红溶液?
(5)C
本题解析:
本题难度:一般