1、推断题 已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子,?B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式?____________;F离子电子排布式__________。
(2)写出X的化学式__________和化学名称__________。?
(3)写出X涉及化工生产中的一个化学方程式__________。
(4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因:__________。
(5)CE、FA的晶格能分别为786?KJ/mol、3401KJ/mol,试分析导致两者晶格能差异的主要原因是__________。
(6)F与B可形成离子化合物,其晶胞结构如图所示:?F与B形成离子化合物的化学式为
__________;该离子化合物晶体的密度为a?g/cm3,则晶胞的体积是__________。(只要求列出算式)。

参考答案:(1)2s22p4;1s22s22p63s23p6
(2)Na3AlF6;六氟合铝酸钠
(3)2Al2O3(融熔) 2Al+3O2↑
2Al+3O2↑
(4)Al2O3为离子晶体而AlCl3为分子晶体
(5)CaO晶体中Ca2+、O2-的带电量大于NaCl晶体中Na+、Cl-
(6)CaF2;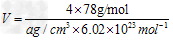
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
[? ]
A.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B.非金属元素呈现的最低化合价的绝对值等于该元素原子的最外层电子数
C.最外层有2个电子的原子都是金属原子
D.最外层有5个电子的原子都是非金属原子
参考答案:A
本题解析:
本题难度:一般
3、简答题 化学中用类比的方法可预测许多物质的性质,如根据H2+Cl2═2HCl,推测:H2+Br2═2HBr,但类比是相对的,如根据2Na2O2+2CO2═2Na2CO3+O2类推2Na2O2+2SO2═2Na2SO3+O2是错误的,应该为Na2O2+SO2═Na2SO4.
(1)下列各组类比中正确的为______.
A.由元素周期表中Al和Ge元素的相似性,推测钙(Ca)元素与铷(Rb)元素性质相似
B.由NH4Cl═NH3↑+HCl↑推测NH4I═NH3↑+HI↑
C.由2CO2+Ca(ClO)2+2H2O═Ca(HCO3)2+2HClO推测CO2+NaClO+H2O═NaHCO3+HClO
D.由Fe3O4+8HCl═FeCl2+2FeCl3+4H2O推测Pb3O4与浓盐酸反应的化学方程式为:Pb3O4+8HCl(浓)═2PbCl2+PbCl4+4H2O
(2)根据月球中用N元素代替O元素的事实,推测地球上的葡萄糖的结构简式[CH2OH(CHOH)4CHO]在月球上应为______.
(3)从2F2+2H2O═4HF+O2反应预测2F2+4NaOH═4NaF+2H2O+O2.然而经实验,在某条件下,物质的量相等的F2和NaOH恰好完全反应,生成氟化钠、水和一种气体,请根据实验结果写出反应的化学方程式______.
参考答案:(1)A、元素周期表中,Al和Ge元素处于对角线位置,元素性质相似,但是钙(Ca)元素与铷(Rb)元素不具备该种位置关系,故A错误;
B、由NH4Cl═NH3↑+HCl↑推测NH4I═NH3↑+HI↑,但是碘化氢受热易分解为碘单质和氢气,所以碘化铵受热分解的产物是氨气、碘蒸气和氢气,故B错误;
C、碳酸酸性强于次氯酸,并且过量二氧化碳参加反应对应产物是碳酸氢盐,由2CO2+Ca(ClO)2+2H2O═Ca(HCO3)2+2HClO推测CO2+NaClO+H2O═NaHCO3+HClO,故C正确;
D、铅的化合物中+4价的铅不稳定,Pb3O4与浓盐酸反应的化学方程式为:Pb3O4+8HCl=3PbCl2+Cl2↑+4H2O,故D错误.
故选C.
(2)将葡萄糖的结构简式[CH2OH(CHOH)4CHO]中的氧元素改为氮元素,氮元素周围满足三价键理论,结果为:H2NCH2(CHNH2)CH=NH,故答案为:H2NCH2(CHNH2)CH=NH;
(3)物质的量相等的F2和NaOH恰好完全反应,生成氟化钠、水和一种气体,先根据水中氢原子和氢氧化钠中氢原子的数目关系确定氟气和氢氧化钠均为2mol,根据原子守恒确定气体是OF2,故答案为:2F2+2NaOH=2NaF+OF2+H2O.
本题解析:
本题难度:一般
4、选择题 关于砷元素性质的说法不正确的是
A.砷很难与氢气发生化合反应
B.砷的含氧酸有H3AsO4和H3AsO3
C.砷的氢化物有AsH3和AsH5
D.砷的常见化合价有-3,+3,+5
参考答案:C
本题解析:
本题难度:困难
5、简答题 下表是元素周期表的一部分,按要求填空(填元素符号或化学式):
族
周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0
2
①
②
3
③
④
⑤
⑥
⑦
⑧
⑨
4
⑩
|
(1)写出下列元素的元素符号:①______②______
(2)在这些元素中,最活泼的金属元素是______,最活泼的非金属元素是______,最不活泼的元素是______.
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是______,碱性最强的是______,呈两性的氢氧化物是______.
(4)在③与④的单质中,化学性质较活泼的是______,判断依据是______;在⑧的单质中,化学性质较为活泼的是______,判断依据是______.
参考答案:(1)根据元素的周期数和族序数,可以判断①是N,②是F,③是Na,④是Mg,⑧是Cl,故答案为:N;F;
(2)周期表中,从上到下金属的活泼性逐渐增强,非金属性逐渐减弱;从右到左金属活泼性逐渐增强,非金属性逐渐减弱,所以活泼金属在周期表的左下角,即该表中最活泼的金属元素是K,最活泼的非金属元素是F,稀有气体化学性质稳定,所以最不活泼的元素是Ar,故答案为:K;F;Ar;;
(3)周期表中,从上到下元素的最高价氧化物对应水化物的碱性逐渐增强,酸性逐渐减弱,从左到右元素的最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱,在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4 ,碱性最强的是KOH,呈两性的氢氧化物是氢氧化铝,故答案为:HClO4 ;KOH;Al(OH)3 ;
(4)同周期元素,从左向右,金属性逐渐减弱,所以金属钠比金属镁活泼,可以根据金属镁和金属钠与冷水的反应来判断:钠与冷水剧烈反应,而镁与冷水几乎不反应,同主族元素,从上到下,单质的氧化性逐渐减弱,所以在氯气和溴的单质中,化学性质较为活泼的是氯气,因为氯气可以与溴化钾反应,置换出单质溴,
故答案为:Na;钠与冷水剧烈反应,而镁与冷水几乎不反应;Cl2;氯气可以与溴化钾反应,置换出单质溴.
本题解析:
本题难度:一般