1、选择题 利用废铜屑制取硝酸铜溶液的最好方法是
[? ]
A.铜屑与稀硝酸混合加热
B.铜屑与浓硝酸混合
C.铜屑在空气中灼烧后再溶于稀硝酸
D.铜屑与硝酸银溶液混合
参考答案:C
本题解析:
本题难度:简单
2、选择题 为证明铁的金属活动性比铜强,某同学设计了如下4个方案,其中能证明铁的金属活动性比铜强的方案是
[? ]
方案
?现象或产物
A.
将铁片置于CuSO4溶液中
铁片上有亮红色物质析出
B.?
将铁丝和铜丝分别在氯气中燃烧
产物分别为FeCl3和CuCl2
C.
将铁片和铜片分别放入热浓硫酸中
分别为Fe2(SO4)3和CuSO4
D.
将铜片置于FeCl3溶液中?
铜片逐渐溶解
参考答案:A
本题解析:
本题难度:一般
3、选择题 相同质量的四份铜片,分别置于足量的下列酸中,所得到的气体的物质的量最多的是
[? ]
A.浓硫酸
B.稀硫酸
C.浓硝酸
D.稀硝酸
参考答案:C
本题解析:
本题难度:简单
4、选择题 将等质量的铜片在酒精灯上加热后,分别加入下列溶液中,放置片刻,取出金属片干燥称量,金属片质量由小到大的顺序正确的是①硝酸?②盐酸?③无水乙醇?④石灰水( )
A.①②③④
B.②①③④
C.①④③②
D.④②①③
参考答案:A
本题解析:
本题难度:简单
5、填空题 近年来,我国的电子工业迅速发展,造成了大量的电路板蚀刻废液的产生和排放.蚀刻液主要有酸性的(HCl-H2O2)、碱性的(NH3-NH4Cl)以及传统的(HCl-FeCl3)等3种.蚀刻废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失.几种蚀刻废液的常用处理方法如下:
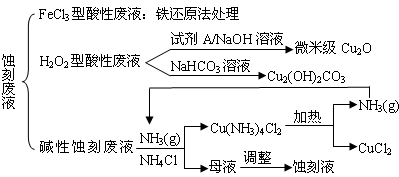
(1)FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生.发生的主要化学反应有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还有______、______.(用离子方程式表示).
(2)HCl-H2O2型蚀刻液蚀刻过程中发生的化学反应用化学方程式可表示为:______.
(3)H2O2型酸性废液处理回收微米级Cu2O过程中,加入的试剂A的最佳选择是下列中的______(填序号)
①酸性KMnO4溶液?②NaCl(固)?③葡萄糖?④甲醛
(4)处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是______.
(5)碱性蚀刻液发生的化学反应是:2Cu+4NH4Cl+4NH3?H2O+O2=2Cu(NH3)4Cl2+6H2O,处理碱性蚀刻废液过程中加入NH4Cl固体并通入NH3的目的是______.
参考答案:(1)FeCl3型酸性废液中含有Fe3+和Fe2+,Fe3+具有氧化性,可与Fe反应,离子方程式为Fe+2Fe3+=3Fe2+,Fe2+具有还原性,可与Cl2反应,离子方程式为2Fe2++Cl2=2Fe3++2Cl-,
故答案为:Fe+2Fe3+=3Fe2+;2Fe2++Cl2=2Fe3++2Cl-;
(2)H2O2在酸性条件下具有强氧化性,可氧化Cu生成CuCl2,反应的化学方程式为Cu+2HCl+H2O2=CuCl2+2H2O,
故答案为:Cu+2HCl+H2O2=CuCl2+2H2O;
(3)HCl-H2O2型蚀刻液含有Cu2+,在碱性条件下生成Cu(OH)2,可与弱还原剂生成Cu2O,选项中葡萄糖和甲醛都可,但葡萄糖资源广,无害,最合适,故答案为:③;
(4)当温度高于80℃时,Cu2(OH)2CO3易分解生成黑色CuO,导致产品颜色发暗,
故答案为:温度高会使产物部分分解产生黑色的氧化铜导致产品颜色发暗;
(5)Cu2+易与NH3发生反应生成配合物Cu(NH3)4Cl2,促使溶液中Cu(NH3)4Cl2结晶析出,故答案为:促使溶液中Cu(NH3)4Cl2结晶析出.
本题解析:
本题难度:一般