1、填空题 已知:A为淡黄色固体,E、X常温下为气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。
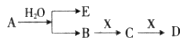
请回答下列问题:
(1)B中所含化学键的类型是______________;
(2)常温常压下,7.8g A与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式____________________。
(3)①C也可转化为B,写出该转化的化学方程式_______________;
②B与D反应的离子方程式为__________________________。
(4)将一定量的气体X通入2L B的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。
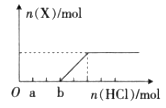
请回答:a点溶液中所含溶质的化学式为__________,b点溶液中各离子浓度由大到小的关系是___________________。
(5)将C溶液与氢氧化钡溶液混合可得不溶物F,F的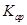 =2.5×
=2.5×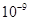 。现将该沉淀放入0.5 mol·
。现将该沉淀放入0.5 mol·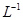 的BaCl2溶液中,其
的BaCl2溶液中,其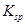 ________(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为________mol·
________(填“增大”、“减小”或“不变”),组成不溶物F的阴离子在溶液中的浓度为________mol·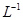 。
。
参考答案:(1)(极性)共价键、离子键(2分)(多答、错答、漏答不得分)
(2)2Na2O2(s)+2H2O(l)=4NaOH(aq)+O2(g)?△H=-20a kJ·mol-1(2分)
(3)①Ca(OH)2 + Na2CO3=CaCO3↓ + 2NaOH (2分) [用Ba(OH)2代替Ca(OH)2也可。]
②OH- + HCO3- =CO32-+H2O(2分)
(4)Na2CO3、NaCl(2分)(多答、错答、漏答不得分)
c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)(2分)[c(CO32-)可写可不写,不作评分依据。]
(5)不变(1分)? 5.0×10-9(2分)
本题解析:由转化关系知:A为Na2O2,E为O2,X为CO2,B为NaOH,C为Na2CO3,D为NaHCO3。(1)NaOH中存在(极性)共价键、离子键。(2)书写热化学方程式要注明物质的状态,要注意热量值与物质的化学计量数成比例。(3)C转化为B为复分解反应,书写时应注意反应的条件。酸式盐NaHCO3与NaOH反应生成正盐Na2CO3与H2O。(4)NaOH与CO2反应,CO2的量由少到多,所得溶液中的溶质可能有以下几种情况:NaOH与Na2CO3、Na2CO3、Na2CO3与NaHCO3、NaHCO3四种。根据与盐酸反应量的关系,可确定O点溶液中溶质为NaOH与Na2CO3,且两者物质的量之比为1:2。O点→a点发生反应:NaOH+HCl=NaCl+H2O,a点→b点发生反应:Na2CO3+HCl=NaHCO3+NaCl。b点溶液中各离子浓度由大到小的关系是c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。(5)不溶物F为BaCO3,Ksp仅与温度有关,该沉淀放入0.1 mol·L-1的BaCl2溶液中,其Ksp不变;c(CO32-)=Ksp/ c(Ba2+)=2.5×10-9/0.5=5.0×10-9?mol·L-1。sp的计算。
本题难度:一般
2、填空题 现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
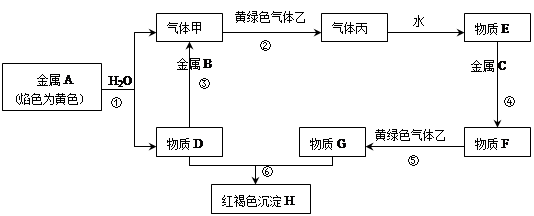
请回答下列问题:
(1)写出下列物质的化学式:B?、丙?、乙?。
(2)写出下列反应的化学方程式:
反应①?;
反应⑤?;
反应⑥??。
参考答案:(1) Al? HCl? Cl2[
(2) ① 2Na+2H2O=2NaOH+H2↑
⑤2FeCl2+Cl2=2FeCl3?
⑥3NaOH+FeCl3=Fe(OH)3↓+3NaCl
本题解析:由金属A焰色反应为黄色知A为钠,则甲为氢气,D为氢氧化钠,B为铝,乙为黄绿色气体,则乙为氯气,丙为氯化氢,E为稀盐酸,H为黄褐色沉淀氢氧化铁,所以C为铁,F为氯化亚铁,G为氯化铁。所以,(1)B:Al、乙:Cl2、丙:HCl;
(2)反应①的方程式:2Na+2H2O=2NaOH+H2↑
反应⑤方程式:2FeCl2+Cl2=2FeCl3
反应⑥方程式:3NaOH+FeCl3=Fe(OH)3↓+3NaCl
本题难度:一般
3、填空题 以淀粉A为原料可以制得有茉莉花香味的H,现按以下方式进行合成该香料(方框中A、B、C、D、E、F均为有机物,同时方框中某些无机产物省略)
已知:RCH2Cl+NaOH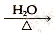 RCH2OH+NaCl
RCH2OH+NaCl

请回答下列问题:
(1)A的化学式为______,B的名称为______。
(2)写出①②的反应类型:①______,②______。
(3)C→D的化学方程式为______,
(4)F+E→H的化学方程式为______,
(5)写出C的两种同分异构体的结构简式______、______。
参考答案:(11分)(1)(C6H10O5)n(1分)葡萄糖(1分)?(2)取代?(1分)氧化(1分)
(3)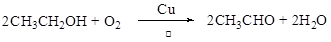 (2分)
(2分)
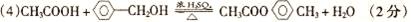
(5)CH3CH2OH、CH3OCH3(只写对1个得1分,写2个给3分)(其它合理答案同样给分)
本题解析:淀粉水解生成葡萄糖,则B是葡萄糖。葡萄糖在酶的作用下分解生成乙醇,则C是乙醇。乙醇分子中含有羟基,能发生催化氧化生成乙醛,及D是乙醛。乙醛含有醛基,被氧化生成羧基,则E是乙酸。甲苯在光照的条件下发生取代反应,生成卤代烃。卤代烃在氢氧化钠的溶液中发生水解反应生成醇,即F是苯甲醇。苯甲醇和乙酸发生酯化反应生成乙酸苯甲酯H。
本题难度:一般
4、填空题 (每空2分,共12分)有X、Y、Z三种单质和甲、乙、丙三种常见的化合物,它们有如下图及叙述所示的关系:
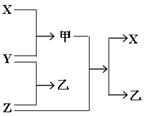
(1)X、Y、Z都是短周期元素的单质,X元素原子的最外层电子数是其次外层电子数的2倍;Y元素有两种常见单质,二者质量相等时其物质的量之比为3 :2;Z元素原子的次外层电子数是其最外层电子数的4倍。则:
①写出化合物甲的电子式___________________;
②写出Z与甲反应的化学方程式_______________________________________________;
(2)X、Y、Z都是非金属单质,X是原子晶体,Y、Z都是分子晶体,X、Y都能与强碱溶液反应;乙的水溶液是工业三酸之一,也是实验室常用试剂。则:
①写出X与NaOH溶液反应的离子方程式________________________________________;
②在①所得溶液中加入乙的溶液,观察到的现象___________________________________
___________________________________?;
(3).X、Z是常见金属,Z与甲的反应只有在高温下才能进行,甲是一种具有磁性的化合物,乙在工业上常用于制取Z单质。则:
①写出乙与NaOH溶液反应的化学方程式______________________?;
②将等物质的量的X和Z分别与足量的稀硫酸反应,当两种金属完全溶解 后,得到气体的质量之比是____________________________。
后,得到气体的质量之比是____________________________。
参考答案:(1)①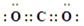 ?②
?②
(2)①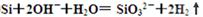 ?②产生白色胶状沉淀
?②产生白色胶状沉淀
(3)①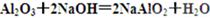 ?②2:3
?②2:3
本题解析:略
本题难度:简单
5、推断题 A、B、C、D、E五种元素均为短周期元素,其原子序数依次增大。A元素原子的核外电子数、电子层数和最外层电子 数均相等;B、C、D、E四种元素在元素周期表中的相对位置如图I如示。另有甲、乙、M、W、X、Y.Z七种物质均由A、C、D 三种元素中的若干种组成(只有M中同时含有三种元素),其中甲、乙为非金属单质,W由A和C组成,分子中含有18个电子,X分子中含有10个电子,它们之间的相互转化关系如图Ⅱ所示。请回答下列问题:
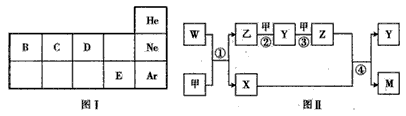
(1)E的单质与NaOH溶液反应的离子方程式为__________ 。
(2)乙的电子式为 ___________,Y的分子式为 ____________,W的分子式为___________ 。
(3)由A、C、D三种元素组成一种强酸弱碱盐的化学式为 _______,其水溶液中各离子的浓度由大到小的顺序为 _______。
(4)反应④的化学方程式为____。
参考答案:
(1)Cl2+2OH-==Cl-+ClO-+H2O
(2)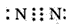 ;NO;N2H4
;NO;N2H4
(3)NH4NO3;c(NO3-)>c(NH4+)>c(H+)>c(OH-)
(4)3NO2+H2O==2HNO3+NO
本题解析:
本题难度:一般