|
高考化学知识点归纳《键参数——键能、键长与键角》高频考点预测(2019年最新版)(二)
2019-06-25 22:41:43
【 大 中 小】
|
1、选择题 A、B、C、D、E五种元素从左向右按原予序数递增(原子序数为5个连续的自然数)的顺序捧列如右:下列说法正确的是( )
A.A(OH)n为强碱时,B(OH)m也一定为强碱
B.E元素的最高化合价为+7价时,D元素的负化合价可为-2价
C.HnDOm为强酸时,E的非金属性一定很强
D.HnCOm为强酸时,E的单质一定有强还原性
| 
参考答案:A.A(OH)n为强碱时,B(OH)m可能为强碱,也可能为中强碱,还可能为弱碱,故A错误;
B.E元素的最高化合价为+7价时,D元素的最高化合价必为+6价,则D元素的负化合价可为-2价,故B正确;
C.HnDOm为强酸,即D元素的非金属性很强,原子序数比D大1的E可能为非金属性比D强的非金属元素,也可能为稀有气体元素,故C错误;
D.若C是16S,则E是18Ar;若C是17Cl,则E是19K,可能具有强还原性,故D错误;
故选B.
本题解析:
本题难度:一般
2、选择题 下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是?(?)
①H2O?②NH3?③Cl-?④SCN-
A.①②
B.①②③
C.①②④
D.①②③④
参考答案:D
本题解析:略
本题难度:简单
3、填空题 【化学——物质结构与性质】(15分)
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E的硫酸盐溶液是制备波尔多液的原料之一。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为?,
1mol M中含有σ键的数目为?。?
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是?。
(3)写出与BD2互为等电子体的C3-的结构式?。
(4)E+的核外电子排布式为??,图12是E的某种氧化物的晶胞结构示意图,氧的配位数为??。
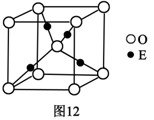
(5)向E的硫酸盐溶液中通入过量的CA3,写出该反应的离子方程式:?。
参考答案:(15分)(1)sp2? 3NA(或3×6.02×1023)?(每空2分)
(2)NH3分子间能形成氢键?(2分)?
(3)[N=N=N]-?(2分)?
(4)1s22s22p63s23p63d10? 4?(每空2分)
(5)Cu2++4NH3=[Cu(NH3) 4]2+?(3分)
本题解析:B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,B的电子占据1s,2s,2p三个轨道,且每个轨道中电子数为2,B原子共有6个核外电子,B为碳元素;D原子有2个未成对电子,1s22s22p2或1s22s22p4,可能为C、O,则D为O;C为N;A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,有害气体为甲醛,A为H;E的硫酸盐溶液是制备波尔多液的原料之一,E为铜;A为H,B为C;C为N;D为O;E为铜;
(1)甲醛空间构型为平面三角形,中心原子碳,采用sp2;
本题难度:一般
4、简答题 (2008?上海,23)四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.
| 元素 | A | B | C | D
性质或
结构
信息
室温下单质呈粉末状固体,加热易熔化;单质在氧气中燃烧,发出明亮的蓝紫色火焰
单质常温、常压下是气体,能溶于水;原子的M层上有7个电子
单质质软、银白色固体、导电性强;单质在空气中燃烧发出黄色的火焰
原子最外电子层有4个电子;单质为空间网状晶体,具有很高的熔、沸点
|
(1)B元素在周期表中的位置是______,写出A原子的电子式______.
(2)写出C单质与水反应的化学方程式______.A与C形成的化合物溶于水后,溶液的pH______7(填“大于”“等于”或“小于”).
(3)D元素最高价氧化物晶体的硬度______(填“大”或“小”),其理由是______.
(4)A、B两元素非金属性较强的是(写元素符号)______.写出能证明这一结论的一个实验事实______.
参考答案:(1)B元素从“气体”可知是非金属元素,从M层上有7个“电子”知是Cl元素,位于元素周期表第三周期ⅦA族,
A元素的单质在氧气中燃烧,发出明亮的蓝紫色火焰,应是S元素,其电子式为
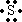
,
故答案为:第三周期ⅦA族;
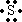
;
(2)C单质的焰色反应呈黄色,则C为Na,为活泼金属,与水剧烈反应生成NaOH和氢气,
反应的方程式为2Na+2H2O═2NaOH+H2↑,生成NaOH,溶液呈碱性,PH大于7,
故答案为:2Na+2H2O═2NaOH+H2↑;大于;
(3)D元素最外层电子数为4,结合空间网状结构和“很高的熔、沸点”应该是C元素或Si元素,
最高价氧化物为SiO2或CO2,SiO2是原子晶体,硬度大,CO2是分子晶体,硬度小,
故答案为:大;SiO2是原子晶体(或小;CO2是分子晶体);
(4)同周期元素从左到右元素的非金属性逐渐增强,比较元素非金属性的强弱可从它们之间的相互置换、氢化物的稳定性、最高价氧化物的水化物的酸性强弱等方面去判断,
故答案为:Cl;高氯酸的酸性大于硫酸的酸性或氯化氢稳定性比硫化氢强.
本题解析:
本题难度:一般
5、选择题 气体分子中的极性键在红外线的照射下,易像弹簧一样做伸缩和弯曲运动,从而产生热量而造成温室效应。下列不属于温室效应气体的是( )
A.CO2
B.N2O
C.CH4
D.N2
参考答案:D
本题解析:氮气中的化学键是非极性键,因此根据题意可知,不属于温室效应气体,答案选D。
点评:该题是基础性试题的考查,难度不大。该题设计新颖,有助于调动学生的学习兴趣和学习积极性。该题的关键是准确判断出分子中含有的化学键类型,然后结合题意灵活运用即可,有助于培养学生的自学能力。
本题难度:简单
| 