1、选择题 0.1mol?L-1氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是( )
①电离程度增大 ?②c(NH3?H2O)增大?③NH4+数目增多
④c(OH-)增大? ⑤导电性增强 ?⑥
增大.
A.①②③
B.①③⑤
C.①③⑥
D.②④⑥
参考答案:①因加水促进弱电解质的电离,则氨水的电离程度增大,故①正确;
②加水时电离平衡正向移动,n(NH3?H2O)减小,且溶液的体积变大,则c(NH3?H2O)减小,故②错误;
③加水时电离平衡正向移动,n(NH4+)增大,由N=n×NA,则NH4+数目增多,故③正确;
④加水时电离平衡正向移动,n(OH-)增大,但溶液的体积变大,则c(OH-)减小,故④错误;
⑤加水稀释时,溶液中的离子的浓度减小,则导电性减弱,故⑤错误;
⑥加水时电离平衡正向移动,n(NH4+)增大,n(NH3?H2O)减小,在同一溶液中体积相同,离子的浓度之比等于物质的量之比,则C(NH+4)C(NH3?H2O)增大,故⑥正确;
故选C.
本题解析:
本题难度:简单
2、选择题 将H+浓度相同,溶液体积也相同的两种酸溶液(甲:盐酸;乙:醋酸)分别与锌反应,若最后有一溶液中有锌剩余,且放出的气体一样多,对此有如下判断:
(1)反应所需时间乙<甲(2)开始时反应速率甲>乙(3)参加反应的锌的质量甲=乙(4)整个反应阶段的平均速率乙>甲(5)盛盐酸的容器中有锌剩余(6)盛醋酸的容器中有锌剩余
以上判断正确的是(? )
A.(1)(2)(3)(5)
B.(1)(3)(5)
C.(2)(3)(6)
D.(1)(3)(4)(5)
参考答案:D
本题解析:盐酸是强酸,醋酸是弱酸,当两者H+浓度相同时,醋酸浓度比盐酸浓度大得多。依题意与锌反应放出的氢气一样多,则参加反应的锌以及参加反应的酸一样多,故盐酸反应完,醋酸有剩余。盐酸中有锌剩余。由于两者H+浓度相同所以开始反应速率相等,但由于醋酸存在电离平衡,当H+浓度减小时平衡右移补充H+浓度,故反应较快。
本题难度:简单
3、选择题 HA为酸性略强于醋酸的一元弱酸,则下列叙述正确的是
A.0. 1 mol?L-1 HA中c(H+)= c(OH-)+ c(A-)
B.0. 1 mol?L-1 HA与 0. 1 mol?L-1NaOH 混合至溶液呈中性:c(Na+)= c(A-)
C.0. 1 mol?L-1 NaA 中c(Na+)> c(OH-)>c(A-)> c(H+)
D.0. 1 mol?L-1 HA中加入少量NaA固体,HA的电离常数减小
参考答案:AB
本题解析:依题意,HA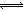 H++A—、H2O
H++A—、H2O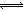 H++OH—,则稀HA溶液中含有A—、OH—、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+ c(OH-) = c(H+),故A选项正确;酸碱中和反应后所得溶液中含有A—、OH—、Na+、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+c(OH-)=c(Na+)+c(H+),若溶液呈电中性,则c(A-) =c(Na+),故B选项正确;NaA=Na++A—、H2O
H++OH—,则稀HA溶液中含有A—、OH—、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+ c(OH-) = c(H+),故A选项正确;酸碱中和反应后所得溶液中含有A—、OH—、Na+、H+,溶液呈电中性,则阴阳离子所带正负电荷总浓度相等,即c(A-)+c(OH-)=c(Na+)+c(H+),若溶液呈电中性,则c(A-) =c(Na+),故B选项正确;NaA=Na++A—、H2O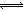 H++OH—,钠离子不能水解,少部分A—能水解生成HA,消耗水电离出的氢离子,促进水的电离,则稀盐溶液中c(Na+)>c(A-)>c(OH-)>c(H+),故C选项错误;稀HA溶液中存在电离平衡:HA
H++OH—,钠离子不能水解,少部分A—能水解生成HA,消耗水电离出的氢离子,促进水的电离,则稀盐溶液中c(Na+)>c(A-)>c(OH-)>c(H+),故C选项错误;稀HA溶液中存在电离平衡:HA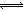 H++A—,NaA是强电解质,加入NaA固体,其完全电离出的A—增大溶液中c(A-),增大生成物浓度使弱酸电离平衡向逆反应方向移动,但HA的电离平衡常数只与温度有关,温度不变电离平衡常数不变,故D选项错误。
H++A—,NaA是强电解质,加入NaA固体,其完全电离出的A—增大溶液中c(A-),增大生成物浓度使弱酸电离平衡向逆反应方向移动,但HA的电离平衡常数只与温度有关,温度不变电离平衡常数不变,故D选项错误。
本题难度:一般
4、填空题 在相同条件下进行Mg和酸反应的对应实验,相关数据如下:
| 镁的质量
| 酸量
| 开始的反应速率
| 产生H2总量
|
Ⅰ
| 0.24g
| HCl: 0.2 mol/L 100mL
| ν1
| n1
|
Ⅱ
| 0.24g
| CH3COOH:0.2 mol/L 100mL
| ν2
| n2
|
(1)试比较有关量的大小:ν1 ν2、n1 n2 (填“
参考答案:
本题解析:
本题难度:一般
5、选择题 c(H+)相同的等体积的两份溶液A和B,A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是
[? ]
①反应所需要的时间B>A;
②开始反应时的速率A>B;
③参加反应的锌的物质的量A=B;
④反应过程的 平均速率B>A;
⑤盐酸里有锌剩余;
⑥醋酸里有锌剩余。
A.③④⑥
B.②③⑥
C.③④⑤
D.①②⑤
参考答案:C
本题解析:
本题难度:一般