| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《弱电解质电离平衡》试题特训(2019年最新版)(二)
参考答案:C 本题解析:A、加入少量NaCl固体,氢离子浓度不变,v(H2)不变,A正确;B、加入少量水,硫酸被稀释,氢离子浓度减小,v(H2)减小,B正确;C、加入少量CH3COONa固体,醋酸根与氢离子结合,氢离子浓度减小,v(H2)减小,C错误;D、加入少量CuSO4溶液,置换出铜与锌形成原电池,v(H2)变大,D正确;答案选C。 本题难度:一般 2、选择题 pC类似pH,是指极稀溶液中溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol·L-1,则该溶液中溶质的pC=3。下列表达正确的是 参考答案:D 本题解析:pC(H+) +pC(OH-)=14,只是常温下成立,A错;CaCl2溶液中逐渐滴加纯碱溶液,C(Ca2+)减小,pC增大,B错;某浓度的NaOH溶液中滴加盐酸,OH?的物质的量浓度减少,而H+的物质的量浓度增大,即pC(H+)减少,C错。 本题难度:一般 3、选择题 下列说法正确的是 |
参考答案:D
本题解析:A、外加盐不一定会影响水的电离程度,如外加氯化钠对水的电离无影响,错误;B、Ksp与难溶电解质的性质和温度有关,与溶液中相关离子的浓度无关,错误;C、常温下,向10mL PH=3的醋酸溶液中加水稀释后,Ka(CH3COOH)、Kw不变,溶液中C(CH3COO--)/C(CH3COOH) C(OH--)=Ka(CH3COOH)/Kw的值不变,错误;D、常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH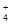 )/c(NH3·H2O)的值增大,正确。
)/c(NH3·H2O)的值增大,正确。
考点:考查水溶液中的离子平衡。
本题难度:一般
4、选择题 25 ℃时纯水的电离度为 a1,pH=2的醋酸溶液中水的电离度为a2,pH=12的氢氧化钠溶液中水的电离度为a3。若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为a4。下列关系式中正确的是
A.a2 = a3<a4<a1
B.a3 = a2<a1<a4
C.a2<a3<a1<a4
D.a1<a2<a3<a4
参考答案:A
本题解析:水电力度与溶液中的氢离子和氢氧根离子有关,pH=2的醋酸氢离子的浓度和pH=12的氢氧化钠溶液中氢氧根离子浓度一样,所以对水的电离影响是一样的,即a2 = a3
又因为将上述醋酸与氢氧化钠溶液等体积混合后溶液呈酸性,所以氢离子抑制了水的电离,所得溶液中水的电离度为a4小于纯水的电离度a1。
点评:本题属于中等题,抓住弱酸为部分电离。理解将上述醋酸与氢氧化钠溶液等体积混合后由于酸溶液过量,所以溶液呈酸性,是解题的关键。
本题难度:一般
5、填空题 (10分)(1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足量的锌粒反应,产生的气体体积前者__________后者(填“<”“>”或“=”)。
(2)写出泡沫灭火器反应原理(用离子方程式表示): 。
(3)医院里用HgCl2的稀溶液作手术刀的消毒剂。HgCl2熔融时不导电,熔点低。HgS难溶于水和稀的强酸却易溶于饱和的NaCl溶液中。试推测HgCl2是 化合物(填“离子”或“共价”),是 电解质(填“强”或“弱”)。
(4)水是一种极弱的电解质,在常温下平均每n个水分子只有1个分子发生电离,n的值是 。
参考答案:(1)=
(2)Al3++3HCO3-=Al(OH)3↓+CO2↑
(3)共价 弱
(4)5.56×108
本题解析:略
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《有机化学反.. | |