|
高考化学必考知识点《化学平衡》考点强化练习(2019年押题版)(二)
2019-06-25 22:46:56
【 大 中 小】
|
1、选择题 能确认发生了化学平衡移动的是 ( )
A.化学反应速率发生了变化
B.物质的浓度发生了变化
C.有气体参加的可逆反应达平衡后,对容器的压强增大
D.由于某一条件的改变,平衡混合物中各组分物质的浓度发生了不同程度的改变
|
参考答案:D
本题解析:略
本题难度:一般
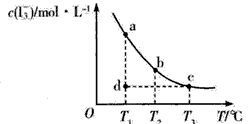
2、选择题 I2在KI溶液中存在下列平衡:I2(aq) +I-(aq)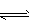 I3-(aq),某I2与KI的混合溶液中,c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是 I3-(aq),某I2与KI的混合溶液中,c(I3-)与温度T的关系如下图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
[? ]
A.反应I2(aq) +I-(aq) I3-(aq) △H >0 I3-(aq) △H >0
B.若温摩为T1、T2时,反应的平衡常数分别为K1、K2,则K2>K1
C.若T1时,反应进行到状态d时,一定有v正>v逆
D.状态a与状态b相比,在状态b时I2的转化率更高
参考答案:C
本题解析:
本题难度:一般
3、选择题 在恒温恒压下,将3mol?A和1mol?B放入一密闭容器中发生反应:2A(g)+B(g)?2C(g),达到化学平衡Ⅰ.在同样条件下,3mol?A和2mol?B发生同样的反应,达到化学平衡Ⅱ.现将平衡Ⅱ的混合气体全部压入平衡Ⅰ的容器中,在同样条件下达到化学平衡Ⅲ.下列关于平衡Ⅰ、Ⅱ、Ⅲ的说法错误的是( )
A.平衡Ⅲ中A的转化率等于B的转化率
B.平衡Ⅰ中A的转化率小于B的转化率
C.n(C)/n(A)的值,平衡Ⅲ的比平衡Ⅰ的小
D.n(A)/n(B)的值,平衡Ⅲ的比平衡Ⅱ的大
参考答案:平衡Ⅰ、Ⅱ、Ⅲ的起始状态可以认为是:
?2?A+B?2C
Ⅰ(mol):3 1 0
Ⅱ(mol):3 2 0
Ⅲ(mol):6 3 0
A、在平衡Ⅲ中,n(A):n(B)=2:1,与化学计量数之比相等,所以α(A)=α(B),故A正确;
B、平衡Ⅰ中n(A):n(B)=3:1,大于化学平衡常数之比,相当于在Ⅲ的基础上又单独加入了A,A的转化率减小,B的转化率增大,所以α(A)<α(B),故B正确;
C、保持恒温恒压,Ⅲ相当于在Ⅰ的基础上又单独加入了B,平衡向右移动,n(C)增大、n(A)减小,会使n(C)/n(A)变大,故C错误;
D、保持恒温恒压,Ⅲ也相当于在Ⅱ的基础上,单独减少了B,会使n(A)/n(B)变大,故D正确;
故选C.
本题解析:
本题难度:一般
4、填空题 (5分)在一定体积的密闭容器中,进行如下化学反应:其化学平衡常数K与温度t的关系如下:CO2(g)+H2(g) 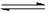 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表: CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t(℃)
| 700
| 800
| 830
| 1000
| 1200
| K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
请回答下列问题:
(1)该反应的化学平衡常数K = 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO) =" 0.01" mol/L, c(H2O) =" 0.03" mol/L, c(CO2) =" 0.01" mol/L,c(H2) =" 0.05" mol/L,则反应开始时,H2O的消耗速率比生成速率 __ _(填“大”、“小”或“不能确定”)。
(4) 830℃,在1L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为 _____,H2的转化率为 ________。
参考答案:(1) K=c(CO)·c(H2O)/c(CO2)·c(H2) (2)吸热 (3)小 (4) 1/3, 2/3
本题解析:(1)化学平衡常数:在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值。故该反应的化学平衡常数为K =c(CO)·c(H2O)/c(CO2)·c(H2)
(2)随着温度的升高,平衡常数越来越大,说明反应向正反应方向进行,故改反应为吸热反应。
(3)由投放物的浓度可知,相当于多投了H2,故反应向正反应方向进行,H2O的消耗速率比生成速率小。
(4)CO2(g)+H2(g) 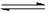 CO(g)+H2O(g) CO(g)+H2O(g)
始态 2 1 0 0
反应 a a a a
终态 2-a 1-a a a
830℃时的平衡常数K=1.0,故得K=a.a/(2-a)(1-a)=1 即a=2/3,故平衡后CO2的转化率为
(2/3)÷2=1/3,H2的转化率为(2/3)÷2=2/3
考点:平衡常数。
点评:此题考核了平衡常数的定义及算法,学生只要理解了平衡常数,就能较好的做此类题,难度不大。
本题难度:一般
5、填空题 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母) ?
A.所需的活化能很高?B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g) 2NO(g)的平衡常数K如下表 2NO(g)的平衡常数K如下表

①该反应的△H____0。(填“>”、“=”或“<”)
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如图所示,请补充完成1760℃、2404℃时N2的转化率随时间变化的示意图。
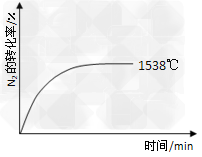
(3)一定条件下该反应在密闭容器中达到平衡后,要提高N2的转化率,可以采取的措施是_________。
A.降低温度?B.加催化剂?C.增加压强?D.增加O2浓度?E.分离出一氧化氮
(4)2404℃时,在容积为1.0L的密闭容器中通入2.6mol?N2和2.6mol?O2,计算反应N2(g)+O2(g) 2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字) 2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
(5)NO在科学界被誉为“明星分子”,?用NO与O2反应可以制备NO2,NO2是一种优良的氧化剂。已知火箭发射时可用肼(N2H4)作燃料,NO2作氧化剂,这两者反应生成N2和H2O(气)。且:
N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol ?
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol
请写出肼与NO2反应的热化学方程式_____________________
参考答案:(1)A
(2)①>
②? (3)DE (3)DE
(4)0.20?mol·L-1?
(5)N2H4(g)+NO2(g)=3/2N2(g)+2H2O(g)?△H=-567.85kJ/mol或2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)?△H=-1135.7kJ/mol
本题解析:
本题难度:一般
|