|
高考化学必考知识点《化学平衡》考点强化练习(2019年押题版)(四)
2019-06-25 22:46:56
【 大 中 小】
|
1、选择题 已知:C+CO2 2CO,正反应为吸热反应,达到平衡后,改变下列条件,能使平衡常数增大的是 2CO,正反应为吸热反应,达到平衡后,改变下列条件,能使平衡常数增大的是
A.升温
B.加压
C.降温
D.使用催化剂
|
参考答案:A
本题解析:对于某一可逆反应化学方程式的平衡常数只与温度有关,故B、D错误;要是平衡常数增大,即平衡正向移动,C+CO2 2CO,正反应为吸热反应,故改变条件应为升高温度,故A项正确、C项错误。 2CO,正反应为吸热反应,故改变条件应为升高温度,故A项正确、C项错误。
考点:平衡常数考查。
本题难度:一般
2、选择题 反应2A(g)
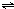
2B(g)+C(g);正反应吸热,达平衡时,要使v正降低、c(A)增大,应采取的措施是( )
A.加压
B.减压
C.减小c(B)
D.降温
参考答案:A.增大压强,平衡向逆反应方向移动,正逆反应速率都增大,故A错误;
B.减小压强,平衡向正反应方向移动,正反应速率减小,c(A)减小,故B错误;
C.减小c(B),平衡向正反应方向移动,c(A)减小,故C错误;
D.降低温度,正逆反应速率都减小,平衡向逆反应方向移动,c(A)增大,故D正确.
故选D.
本题解析:
本题难度:简单
3、填空题 (14分)丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l);△H=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH="-566" kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的△H=
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:
CO (g)+H2O(g) CO2(g)+H2 (g) CO2(g)+H2 (g)
①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化 b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再发生变化
② T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
时间 / min
| CO
| H2O(g)
| CO2
| H2
| 0
| 0.200
| 0.300
| 0
| 0
| 2
| 0.138
| 0.238
| 0.062
| 0.062
| 3
| 0.100
| 0.200
| 0.100
| 0.100
| 4
| 0.100
| 0.200
| 0.100
| 0.100
| 5
| 0.116
| 0.216
| 0.084
| C1
| 6
| 0.096
| 0.266
| 0.104
| C2
|
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。则第4~5min之间,改变的条件 ,第5~6min之间,改变的条件是 。
已知420℃时,该化学反应的平衡常数为9。如果反应开始时,CO和H2O(g)的浓度都是0.01 mol/L,则CO在此条件下的转化率为 。又知397℃时该反应的平衡常数为12,请判断该反应的△H 0 (填“>”、“=”、“<”).
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;
燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—移向_ ___极(填“正”或“负”);电池的负极反应式为 。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____ 。
参考答案:⑴-2219.9kJ/mol(2分)
(2)①bd (2分)②增加H2浓度(1分)增加H2O(g)浓度(1分) 75%(2分)△H<0(1分)
(3)负(1分) C3H8+10O2--20e-=3CO2+4H2O(2分)
(4)有大量无色气泡(或气体)产生,并且有白色沉淀产生(2分)
本题解析:(1)考查盖斯定律的应用,根据已知反应可知,(①+②×3)÷2即得到C3H8(g)+5O2(g)=3CO2(g)+4H2O(l),所以△H=(-2741.8kJ/mol-566 kJ/mol×3)÷2=-2219.9kJ/mol。
(2)①在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以d正确。反应前后体积不变,压强始终是不变的,所以a不正确。B中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确。混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量和物质的量都是不变的,所以c不能说明。答案选bd。
②根据4min和5min浓度变化可知,CO2浓度减少,反应物浓度增加,且变化量满足化学计量数之比,所以改变的条件应该是增大氢气的浓度。根据5min和6min浓度变化可知,CO浓度减小,水蒸气浓度增大,CO2浓度增大,且CO的减少量和CO2的增加量相同,所以改变的条款是增大水蒸气的浓度。CO在此条件下的转化率为,则平衡时生成CO2和氢气分别是0.01xmol/L,因此有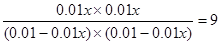 ,解得x=0.75,即转化量是75%。降低温度平衡常数增大,说明降低温度,平衡向正反应方向移动,所以正反应是放热反应。 ,解得x=0.75,即转化量是75%。降低温度平衡常数增大,说明降低温度,平衡向正反应方向移动,所以正反应是放热反应。
(3)原电池中负极失去电子,所以阴离子向负极移动,丙烷在负极通入。所以负极电极反应式为C3H8+10O2--20e-=3CO2+4H2O。
(4)电解池中阴极得到电子,所以是溶液中氢离子放电,生成氢气,则同时生成OH-,所以同时液会产生氢氧化镁沉淀。
本题难度:一般
4、简答题 在硫酸工业中,SO2转化为SO3是一个关键步骤.
(1)SO2有氧化性又有还原性,还有漂白性.将SO2氧化通入酸性KMnO4溶液中,溶液褪色,SO2表现______性,其中氧化剂和还原剂物质的量之比为______(已知KMnO4酸性条件下的还原产物为Mn2+).
(2)某温度下,SO2(g)+ O2(g)?SO3(g);△H=-98 kJ?mol-1.开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时放出热量196kJ,该温度下平衡常数K=______.
(3)下列关于2SO2(g)+O2(g)?2SO3(g);△H=-196kJ?mol-1反应的如图1图象中,错误的是______.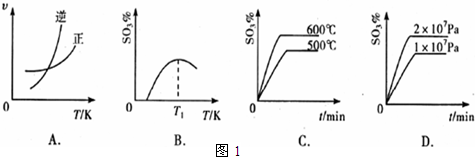
(4)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)?2SO3(g),达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是______(填字母).
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 mol O2
D.保持容器体积不变,升高混合气体温度
E.移动活塞压缩气体
(5)某人设想以如图2装置生产硫酸,写出a电极的电极反应式______.检验SO42-的具体操作为______.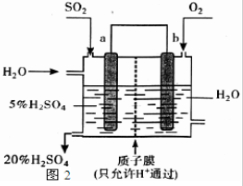
参考答案:(1)SO2气体通入酸性KMnO4中,酸性KMnO4褪色,高锰酸钾中锰元素是最高价具有氧化性,二氧化硫具有还原性;Mn元素化合价由+7价降低到+2价,化合价变化5价,S元素化合价由+4价升高到+6价,化合价变化2价,氧化还原反应中氧化剂和还原剂得失电子数目相等,则氧化剂和还原剂物质的量之比为2:5,
故答案:还原;2:5;
(2)SO2(g)+12O2(g)?SO3(g);△H=-98kJ?mol-1,在100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196kJ,则消耗SO2 2mol,
SO2(g)+12O2(g)?SO3(g);△H=-98kJ?mol-1,
起始 4.0mol 10.0mol 0
转化 2.0mol 1.0mol 2mol
平衡 2.0mol 9.0mol 2mol
则平衡时:c(SO2)=0.02mol/L,c(O2)=0.09mol/L,c(SO3)=0.02mol/L,
所以k=0.020.02×
本题解析:
本题难度:一般
5、填空题 (一)、将2 mol SO2和1 mol O2气体在1L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g) 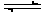 ?2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L。试计算:(1)O2的化学反应速率V(O2)=?; (2)2s时的O2浓度?。 ?2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L。试计算:(1)O2的化学反应速率V(O2)=?; (2)2s时的O2浓度?。
(二)、某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如下图所示。
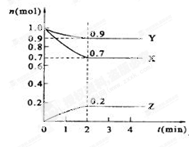
(1)X的转化率是?
(2)由图中所给数据进行分析,该反应的化学方程式为?;
(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=?;
(4)当反应进行到第?min,该反应达到平衡。
参考答案:(1) υ(O2)="0" .15mol/(L·s)? c(O2)=0.7? mol/L
(2) 30%? 3X+Y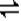 2Z? 0.05mol/(l.·min)? 2 2Z? 0.05mol/(l.·min)? 2
本题解析:(一) 2s后测得SO3的浓度为0.6 mol/ L,所以V(O2)="0.5" V(SO2)=0.5 0.6/2=0 .15mol/(L·s),2s时的O2浓度=1-0 .15 0.6/2=0 .15mol/(L·s),2s时的O2浓度=1-0 .15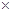 2=0.7 mol/L; 2=0.7 mol/L;
(二)由图可以知道,每反应0.1molY,和0.3molX就生成了0.2mol的Z,所以其反应的化学方程式为3X+Y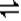 2Z,? X的转化率=0.3/1 2Z,? X的转化率=0.3/1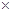 100%=30%,(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=0.2/2/2= 0.05mol/(l.·min);(4)由图可以看出,当反应时间为2min时,各物质的浓度均不再变化,所以当反应进行到第2min,该反应达到平衡。 100%=30%,(3)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=0.2/2/2= 0.05mol/(l.·min);(4)由图可以看出,当反应时间为2min时,各物质的浓度均不再变化,所以当反应进行到第2min,该反应达到平衡。
点评:本题考查了化学平衡,反应速率的相关计算,是高考考查的重点,该题综合性强,但难度不大。
本题难度:一般
| 
