1、填空题 (14分)
(1)纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)= ;
若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)= 。
(2)在CH3COONa的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)明矾的水溶液显酸性,其原因是(用离子方程式表示) 。
(4)在25℃、101kPa下,0.5mol的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为 。
(5)1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为 。
(6)已知:①N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol ;
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534 kJ/mol
则N2H4与NO2与完全反应生成氮气和气态水的热化学方程式为 。
参考答案:(1)5.0×10-7mol/L (2分) 5.0×10-11mol/L(2分)
(2)c( Na+) > c(CH3COO-) > c( OH-)> c(H+)(2分),
(3)Al3+ + 3H2O  Al(OH)3 + 3H+(2分) Al(OH)3;
Al(OH)3 + 3H+(2分) Al(OH)3;
(4)CH3OH (l)+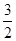 O2 (g) =CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1
O2 (g) =CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1
(5)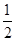 H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=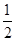 Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1(2分)
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1(2分)
(6)2 N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1 (2分)
或写成2N2H4 (g) + NO2 (g) =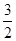 N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1
N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1
本题解析:(1)在纯水中存在电离平衡:H2O H++OH-,纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)=5.0×10-7mol/L. Kw=2.5×10-13;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)=Kw÷c(H+)=2.5×10-13÷5.0×10-3=5.0×10-11mol/L;(2)在CH3COONa的溶液中,由于CH3COO-水解消耗,所以c( Na+) > c(CH3COO-);水解消耗水电离产生的H+,破坏了水的电离平衡,最终使溶液中的OH-的浓度大于H+的浓度,c( OH-)> c(H+)。但是盐的水解程度是微弱的,盐电离产生的离子浓度远大于水电离产生的离子的浓度,所以c(CH3COO-) > c( OH-) c(H+)。故各离子的物质的量浓度由大到小的顺序是c( Na+) > c(CH3COO-) > c( OH-)> c(H+);(3)明矾的水溶液显酸性,其原因是Al3+ + 3H2O
H++OH-,纯水中c(H+)=5.0×10-7mol/L,则此时纯水中的c(OH-)=5.0×10-7mol/L. Kw=2.5×10-13;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,则c(OH-)=Kw÷c(H+)=2.5×10-13÷5.0×10-3=5.0×10-11mol/L;(2)在CH3COONa的溶液中,由于CH3COO-水解消耗,所以c( Na+) > c(CH3COO-);水解消耗水电离产生的H+,破坏了水的电离平衡,最终使溶液中的OH-的浓度大于H+的浓度,c( OH-)> c(H+)。但是盐的水解程度是微弱的,盐电离产生的离子浓度远大于水电离产生的离子的浓度,所以c(CH3COO-) > c( OH-) c(H+)。故各离子的物质的量浓度由大到小的顺序是c( Na+) > c(CH3COO-) > c( OH-)> c(H+);(3)明矾的水溶液显酸性,其原因是Al3+ + 3H2O  Al(OH)3 + 3H+;(4)燃烧热是1mol的可燃物完全燃烧产生稳定的氧化物时所放出的热量,根据题意可得甲醇燃烧热的热化学方程式为CH3OH (l)+
Al(OH)3 + 3H+;(4)燃烧热是1mol的可燃物完全燃烧产生稳定的氧化物时所放出的热量,根据题意可得甲醇燃烧热的热化学方程式为CH3OH (l)+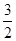 O2 (g)=CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1;(5)中和热是酸碱发生中和反应产生1mol的水时所放出的热量,由于1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为
O2 (g)=CO2 (g)+2H2O (l) ΔH=-704 kJ·mol-1;(5)中和热是酸碱发生中和反应产生1mol的水时所放出的热量,由于1L 1 mol·L-1 H2SO4溶液与2L 1 mol·L-1 NaOH溶液完全反应,放出114.6kJ热量,则表示中和热的热化学方程式为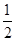 H2SO4(aq)+NaOH(aq)=
H2SO4(aq)+NaOH(aq)=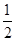 Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;(6)②×2-①,整理可得2 N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1或写为2N2H4 (g) + NO2 (g) =
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;(6)②×2-①,整理可得2 N2H4 (g) + 2NO2 (g) = 3N2 (g) + 4H2O (g) ΔH=-1135.7 kJ·mol-1或写为2N2H4 (g) + NO2 (g) =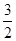 N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1。
N2 (g) + 2H2O (g) ΔH=—567.85 kJ·mol-1。
考点:考查弱电解质的电离、水的离子积常数、盐的水解、盖斯定律的应用、离子浓度比较、中和热、燃烧热的热化学方程式的书写的知识。
本题难度:一般
2、选择题 10、能源可划分为一级能源和二级能源,自然界直接提供的能源为一级能源,需要消耗其它能源的能量间接获取的能源称为二级能源。下列关于能源的说法正确的是
C.电能是一级能源 D.煤气是一级能源
参考答案:A
本题解析:水利可以发电,属于一级能源。电能是二级能源。煤气需要利用碳在高温下和水蒸气反应生成,属于二级能源,所以答案是A。
本题难度:一般
3、选择题 在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线 如图所示,列有关离子浓度的比较正确的是 (?)
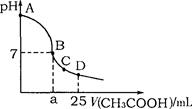
A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
参考答案:A
本题解析:在A、B间任一点(不含A、B点),溶液是碱性的,溶液中可能有c(Na+)>c(OH-)>c(CH3COO-)>c(H+)?;在B点,如果是强酸,a="12.5" 。而醋酸是弱酸,所以a>12.5,且有c(Na+)<c(CH3COO-)?c(OH-)=c(H+)? ; 在C点溶液现酸性,所以c(CH3COO-)>c(Na+)>c(H+)>c(OH-);在D点,c(CH3COO-)+c(CH3COOH)>c(Na+),故选A。
点评:强碱和弱酸溶液混合后,溶液中离子浓度的大小比较:
呈碱性包括两种情况;强碱和强碱弱酸盐的混合溶液及单一强碱弱酸盐溶液;
呈中性: 强碱弱酸盐和少量弱酸的混合溶液;
呈酸性:强碱弱酸盐和大量弱酸的混合溶液。
本题难度:一般
4、实验题 (12分)某学生用0.l000mol.L-l盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应)。实验步骤如下:
(1)配制待测液:用2.50 g含有少量杂质的固体烧碱样品配制500 mL溶液。需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要??。
(2)滴定:
I.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“O”刻度线以上
Ⅱ.固定好滴定管并使滴定管尖嘴充满液体,调节液面至“0”或“O”刻度线以下,并记录读数
Ⅲ.移取20.OOmL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液
Ⅳ.用标准液滴定至终点,记录滴定管液面读数。
①上述滴定步骤中有错误的是(填编号)?,该错误操作会导致测定结果?(填“偏大”、“偏小”或“无影响”)。
②步骤Ⅳ中滴定时眼睛应?:判断滴定终点的现象是?。
③若步骤II中仰视读数,步骤Ⅳ中俯视读数,则会使测定结果?(填“偏大”、“偏小”或“无影响’")。
(3)按正确操作测得有关数据记录如下:
?
滴定次数
| ?
待测液体积
| 标准盐酸体积(mL)
|
滴定前读数(mL)
| 滴定后读数(mL)
|
第一次
| 20.00
| 0.20
| 20.38
|
第二次
| 20.00
| 4.00
| 24.20
|
第三次
| 20.00
| 2.38
| a
|
①a的读数如图所示,则a= ??;

②烧碱样品的纯度为?% 。
参考答案:(12分)(1) 500ml容量瓶(1分)? (2)①Ⅰ(2分)?偏大(1分)?
②注视锥形瓶中溶液颜色的变化(1分)?
溶液由红色刚好变为无色,且半分钟内不变色(2分)
③偏小(1分)? (3) ①22.60(2分)?②80.8%(2分)
本题解析:(1) 配制500ml溶液时,需要500ml容量瓶,所以还需要500ml容量瓶。
(2)①滴定管用水洗涤后,还需要用标准液润洗,否则相当于稀释溶液,因此盐酸的浓度降低,消耗的盐酸溶液体积偏大,则测定结果偏高。
②步骤Ⅳ中滴定时眼睛应注视锥形瓶中溶液颜色的变化。由于选择的指示剂是酚酞,所以终点时的现象是溶液由红色刚好变为无色,且半分钟内不变色。
③若步骤II中仰视读数,则读数偏大。步骤Ⅳ中俯视读数,读数偏小,所以消耗溶液的体积偏少,因此测定结果偏小。
(3)根据滴定管的结构可知,此时的读数应该是a=22.60ml。根据表中数据可知,三次实验中消耗盐酸的体积是20.18ml、20.20ml、20.22ml,所以三次实验的平均值是20.20ml,则氢氧化钠的物质的量是0.00202mol,则纯度是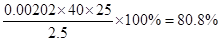 。
。
点评:判断中和滴定中的误差分析的总依据为:由C测==C标V标/V测。由于C标、V待均为定植,所以C测的大小取决于V标的大小,即V标:偏大或偏小,则C测偏大或偏小。根据产生误差的来源,从以下几个方面来分析:①洗涤误差;②读数误差;③气泡误差;④锥形瓶误差;⑤变色误差;⑥样品中含杂质引起的误差等,需要具体问题具体分析。
本题难度:一般
5、选择题 已知反应:① 2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
101KPa ② 稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是
A.碳的燃烧热等于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量