1、选择题 下列叙述正确的是(?)
A.95℃纯水的pH<7,说明加热可导致水呈酸性
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.0.2 mol?L-1的盐酸,与等体积水混合后pH=1
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
参考答案:C
本题解析:加热促进水的电离,但纯水仍然显中性,A不正确。醋酸是弱酸,稀释有利于电离,所以稀释至10倍后pH<4,B不正确。盐酸是强酸,所以0.2 mol?L-1的盐酸,与等体积水混合后浓度是0.1mol/L,所以pH是1,C正确。pH=3的醋酸溶液的浓度大于10-3mol/L,所以和氢氧化钠反应后,醋酸是过量的,因此溶液显酸性,D不正确。所以答案选C。
本题难度:一般
2、选择题 草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
A.V(NaOH)="=" 0时,c(H+,W)="=" 1 × 10-2 mol/L
B.V(NaOH)< 10 mL时,不可能存在c(Na+)="=" 2 c(C2O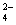 )+ c(HC2O
)+ c(HC2O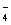 )
)
C.V(NaOH)="=" 10 mL时,c(H+,W)="=" 1 × 10-7mol/L
D.V(NaOH)> 10 mL时,c(Na+)> c(C2O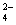 )>c(HC2O
)>c(HC2O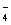 )
)
参考答案:D
本题解析:草酸是二元中强酸,草酸氢钠溶液显酸性,这说明HC2O4-的水解程度小于HC2O4-的电离程度,但电离是不彻底的,所以溶液中氢离子的浓度小于0.01mol/L,A不正确;当V(NaOH)="=" 10 mL时,二者恰好反应时生成草酸钠,水解溶液显碱性。根据电荷守恒可知c(H+)+c(Na+)=" 2" c(C2O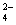 )+ c(HC2O
)+ c(HC2O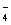 )+c(OH-),如果V(NaOH)< 10 mL,则溶液就可能显中性,则c(H+)=c(OH-),所以c(Na+)="=" 2 c(C2O
)+c(OH-),如果V(NaOH)< 10 mL,则溶液就可能显中性,则c(H+)=c(OH-),所以c(Na+)="=" 2 c(C2O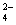 )+ c(HC2O
)+ c(HC2O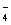 ),即B、C都不正确,选项D正确,答案选D。
),即B、C都不正确,选项D正确,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识的巩固和训练的同时,侧重对学生基础知识的巩固和训练,有利于调动学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是利用好几种守恒关系即电荷守恒、物料守恒和质子守恒,然后结合题意灵活运用即可。
本题难度:简单
3、填空题 (8分)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。请回答下列问题:
(1)已知: ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0kJ /mol
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol
由上述方程式可知,CH3OH(g)的燃烧热____(填“大于”、“等于”或小于”)192.9kJ/mol。已知水的气化热为44 kJ/mol,则表示氢气燃烧热的热化学方程式为______________________________。
(2)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃)
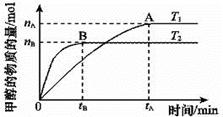
该反应为_________反应(填“放热”或“吸热”);在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为____________________。
参考答案:(1)大于H2 (g)+1/2O2 (g)=H2O(l) ΔH=-124.6KJ/mol;(2)放热 ; (2-a)/2。
本题解析: (1)甲醇的燃烧热是1mol的甲醇完全燃烧产生稳定的氧化物时所放出的热量。水在室温下的稳定状态是液体,1mol的甲醇甲醇完全燃烧产生气态水时所放出的热量是192.9kJ,由于水蒸气变为液态水时会放出热量,所以燃烧热要大于192.9kJ/mol。(②-①)÷3可得H2 (g)+1/2O2 (g)=H2O(g) ΔH=-80.6KJ/mol;由于水的气化热为44 kJ/mol,则表示氢气燃烧热的热化学方程式为H2 (g)+1/2O2 (g)=H2O(g) ΔH=-124.6KJ/mol;(2)由于升高温度,甲醇的平衡含量减少,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,逆反应为吸热反应,说明合成甲醇的反应放热反应;在恒容时,气体的物质的量的比等于压强之比,CO2(g)+3H2(g)=CH3OH(g)+H2O(g),由于加入了1mol的CO2,而且其转化率为a,则达到平衡时各种物质的物质的量是CO2 :(1-a)mol; H2:3(1-a)mol; CH3OH:amol;H2O:amol。n(平衡):n(开始)= [(1-a)+3(1-a)+a+a]:(1+3)=(4-2a):4= (2-a):2。
考点:考查热化学方程式的书写、燃烧热、反应热的判断及恒压时气体的压强比的关系的知识。
本题难度:一般
4、选择题 把一套以液化石油气(主要成分为C3H8和C4H10)为燃料的炉灶,现改用天然气(主要成分为CH4)为燃料,需要调整进入炉灶的燃料气和空气的量。正确方法为
A.同时调大燃料气和空气的量
B.同时调小燃料气和空气的量
C.只需调大燃料气的进气量
D.只需调大空气的进气量