1、选择题 下列表达方式错误的是
A.氟化钠的电子式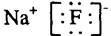
B.氯原子的结构示意图: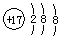
C.CO2分子的结构式:O=C=O
D.甲烷的电子式
参考答案:B
本题解析:氟化钠是离子化合物,A正确;B不正确,氯原子的最外层电子数是7个;CO2和甲烷都是共价化合物,含有极性键,C、D正确,答案选B。
点评:该题是高考中的常见题型与重要的考点,属于中等难度试题的考查。试题基础性强,主要是考查学生对常见化学用语的熟悉掌握程度,旨在考查学生灵活运用基础知识解决实际问题的能力。该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住。
本题难度:一般
2、选择题 元素的种类和原子的种类(?)
A.前者大
B.后者大
C.相等
D.不能确定
参考答案:B
本题解析:略
本题难度:简单
3、选择题 取50mL稀硫酸与一定质量的镁、铝合金反应,合金全部溶解,向所得溶液中滴加5mol?L-1?NaOH溶液到过量,生成沉淀质量与加入NaOH溶液体积关系如图,则( )
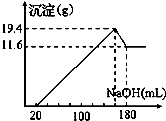
A.原合金中铝质量为7.8g
B.原合金的质量为19.4g
C.原合金中镁的质量为4.8g
D.硫酸的物质的量浓度为5mol?L-1
参考答案:A、氢氧化铝的质量为19.4-11.6=7.8g,故A错误;
B、氢氧化铝和氢氧化铝沉淀的总质量为19.4g,故原合金质量一定小于19.4g,故B错误;
C、氢氧化镁的物质的量等于金属镁的物质的量=11.6g58g/mol×24g/mol=4.8g,故C正确;
D、氢氧化钠溶液加入到溶液至沉淀量最大量时,硫酸全部生成硫酸钠,硫酸物质的量等于氢氧化钠物质的量的12,根据图象可知氢氧化镁物质的量等于镁的物质的量=4.8g24g/mol=0.2mol;氢氧化铝物质的量=7.8g78g/mol=0.1mol,生成这些沉淀共需氢氧化钠物质的量=0.2mol×2+0.1mol×3=0,7mol,需要氢氧化钠的体积为0.7mol5mol/L=0.14L,所以加入氢氧化钠的体积共160ml,此时硫酸根全为硫酸钠,则根据关系;2NaOH~Na2SO4~H2SO4可知 硫酸物质的量=0.16L×52=0.4mol,硫酸的浓度=0.4mol0.05L=8mol/L,故D错误;
故选C.
本题解析:
本题难度:一来源:91 考试网般
4、填空题 (3分)木炭与浓硫酸反应可表示为:C +2H2SO4(浓) CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(1)木炭作 (填“氧化剂”或“还原剂”),硫酸 (填“被氧化”或“被还原”)。
(2)若消耗了1 mol H2SO4,则生成 mol SO2。
参考答案:(1)还原剂 被还原 (2)1
本题解析:(1)C元素化合价升高,被氧化,C为还原剂,S元素化合价降低,被还原,H2SO4为氧化剂,故答案为:还原剂;被还原;(2)由方程式可知,若消耗了1mol H2SO4,则生成1molSO2,故答案为:1.
考点:氧化还原反应
本题难度:一般
5、选择题 实验室将9 g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18 g,则该氧化物粉末可能是( )
①Fe2O3和MnO2 ②MnO2和V2O5 ③Cr2O3和V2O5 ④Fe3O4和FeO
A.①②
B.②④
C.①④
D.②③