1、填空题 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为1.1 g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如下图所示。
请依图回答下列问题
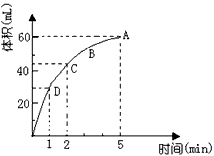
(1)实验时放出气体的总体积为_______________;
(2)放出一半气体所需要的时间为_______________;
(3)ABCD四点化学反应速率的由快到慢顺序为_____________________________;
(4)解释反应速率的大小变化原因________________________________;
(5)在5min后,收集到的气体体积不再增加,原因是________________________________。
参考答案:(1)60mL;
(2)1min;
(3)D>C>B>A;
(4)随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小
(5)此时双氧水已完全分解
本题解析:
本题难度:一般
2、填空题 (14分)在2L带气压计的恒容密闭容器中通入2molX(g)和1molY(g),发生反应:
2X(g)+Y(g) 2Z(g);△H<0若达到平衡时气体总物质的量变为原来的0.85倍。请回答下列问题。
2Z(g);△H<0若达到平衡时气体总物质的量变为原来的0.85倍。请回答下列问题。
(1)平衡时Z的物质的量为___________;若反应经历5min达到平衡,则Y的平均反应速率为____________。
(2)相同条件下进行反应,在t1时刻,只改变下列某一种条件,其曲线图像如图甲。
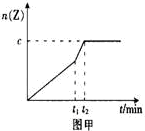
A.升温 B.降温 C.加压 D.减压? E.加催化剂
若c=0.90mol,t1时刻改变的条件是_________(填选项编号,下同),t2_______5min (填“>”,“<”或“=”下同)。
(3)若其他条件不变,原容器为恒压容器,达到平衡后Z的物质的量______0.9mol (填“>”,“<”或“=”)。
(4)若将物质的量均为3.00mol物质X、Y混合于5L容器中发生反应,在反应过程中Z的物质的量分数随温度变化如图乙。
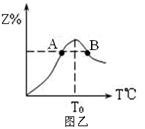
①A、B两点Z物质正反应速率的大小关系是_________;
②温度T<T0时,Z%逐渐增大的原因是______________。
参考答案:(1)0.9mol (2分)? 0.045 mol?L-1?min-1(2分)
(2)E(2分); < (2分)
(3)>(2分)
(4)①B>A;(2分)
②反应未达到平衡,反应仍在向正反应方向进行,故Z%的逐渐增大。(2分)
本题解析:
(1)?2X(g)+Y(g) 2Z(g)
2Z(g)
n(始)? 2mol? 1mol? 0 mol
n(变)? 2a mol? a mol? 2a mol
n(终)? 2-2a mol 1-a mol? 2a mol
3×0.85="2-2a+1-a+2a" ;所以a="0.45" ,平衡时Z的物质的量=2a=0.9mol;Y的反应速率=0.45/(5×2)= 0.045 mol?L-1?min-1。
(2)?只是减少了反应达到平衡的,所以应是加入了催化剂。时间应小于原来的5分钟。
(3)?恒压后,原反应发生过程中,气体体积减小,所以容器体积也在减小,而若为恒容,气体体积减小,压强减小,不利于反应向正向反应,所以恒压后,Z的物质的量大于0.9mol;
(4)?①B点的温度高于A点,温度升高,反应速率增大。
②Z还未达到平衡状态,正反应速率大于逆反应速率,平衡正向反应。所以Z的百分含量会不断升高。
点评:本题计算难度不大,属于常规计算。后面的识图分析,要抓住温度对反应速率的影响。
本题难度:一般
3、选择题 下列说法正确的是
[? ]
A.增大反应物浓度,可以增大单位体积内活化分子的百分数,从而使有效碰撞次数增多
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的总数
D.催化剂能增大单位体积内活化分子的百分数,从而成千成万倍地增大反应速率
参考答案:D
本题解析:
本题难度:一般
4、选择题 铝与过量的稀盐酸反应,为了加快反应速率,同时几乎不影响生成的氢气总量,不可以采取的措施是( )
A.加热,升高溶液温度
B.加入适量的水
C.加入少量CuSO4溶液
D.加入浓度较大的盐酸
参考答案:A、升高温度可加快反应速率,且不影响生成的氢气总量,故A不选;
B、加入适量的水,盐酸的浓度降低,反应速率减小,故B选;
C、加入少量CuSO4溶液,铝与硫酸铜反应置换出铜,形成原电池,反应速率加快,但影响生成的氢气总量,故C选;
D、加入浓度较大的盐酸,反应物浓度增大,反应速率增大,且不影响生成的氢气总量,故D不选.
故选BC.
本题解析:
本题难度:一般
5、填空题 (1)粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO2-4等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号
(2)工业生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(3)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦碳在高温的氮气流中,通过以下反应制得: SiO2 + C + N2 = Si3N4 + CO)
①配平上述反应的化学方程式
②该反应的平衡常数表达式为K=
(4)水是一种重要的自然资源,天然水在净化处理过程中加入的混凝剂可以是 __ (填两种物质名称),其净水作用的原理是
参考答案:(1)③①② (2)否 否 (3)(3分)3,6,2,1,6  或
或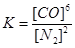
(4)明矾、硫酸铝、硫酸铁、硫酸亚铁(填其中任何两种) (2分)
铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到净化目的
本题解析:(1)应先加入过量BaCl2,除去SO42-,然后加过量Na2CO3,可除去Ca2+、Mg2+、Fe3+等,过滤后加入盐酸可除去Na2CO3,故答案为:③①②;(2)催化剂不能使平衡移动,不能提高SO2的转化率,当然也不能增大该反应所放出的热量。(3)①Si的化合价前后未变,N的化合价由0降为-3,C的化合价由0升为+2,生成1个Si3N4化合价降低12,生成1个CO化合价升高2,根据化合价升降总数相等以及质量守恒得,3SiO2+6C+2N2 = Si3N4+6CO.故答案为:3、6、2、1、6;②固体或纯液体的浓度不改变,故该反应的平衡常数表达式为 或
或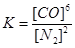
(4)明矾、硫酸铝、硫酸铁、硫酸亚铁中的阳离子铝离子,铁离子都能水解产生胶体能吸附水中的悬浮物,
铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉,达到净化目的
考点:本题前半部分饱和食盐水的精制,催化剂原理,化学平衡常数表达式的书写和常见的净水剂等相关知识。
本题难度:困难