1、选择题 用铁片稀H2SO4反应制取氢气时,下列措施不能使氢气生成速率加大的是
[? ]
A.加热
B.不用稀H2SO4改用98%的浓H2SO4
C.滴加少量CuSO4溶液
D.不用铁片,改用铁粉
参考答案:B
本题解析:
本题难度:简单
2、选择题 已知2A(g) 2B(g)+C(g)ΔH<0,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是
2B(g)+C(g)ΔH<0,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是
A.升温? B.增大反应器的体积? C.增大c(A)? D.降温
参考答案:B
本题解析:A选项升高温度化学反应速率加快。B选项增大反应器的体积,反应物浓度较少,化学反应速率降低。C选项增大A物质的浓度,正反应速率加快,B物质浓度增大,所以B选项是错误的。D选项,该反应为放热反应,降低温度反应速率减慢,反应向放热反应方向移动所以D选项是错误。所以答案选B。
本题难度:一般
3、选择题 把下列四种X溶液分别加入四个盛有10m?L?2mol/L盐酸的烧杯中,均加水稀释到50mL,此时X和盐酸和缓地进行反应.其中反应速率最大的是( )
A.20mL3mol/L的X溶液
B.20mL2mol/L的X溶液
C.10mL4mol/L的X溶液
D.10mL2mol/L的X溶液
参考答案:A、20mL3mol/L的X溶液,X的物质的量为0.02L×3mol/L=0.06mol;
B、20mL2mol/L的X溶液,X的物质的量为0.02L×2mol/L=0.04mol;
C、10mL4mol/L的X溶液,X的物质的量为0.01L×4mol/L=0.04mol;
D、10mL2mol/L的X溶液,X的物质的量为0.01L×2mol/L=0.02mol,
显然四种情况下A中浓度最大,所以反应速率是最大.
故选A.
本题解析:
本题难度:简单
4、选择题 设 (正反应为吸热反应),反应速率为v1;
(正反应为吸热反应),反应速率为v1; 正反应为放热反应),反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
正反应为放热反应),反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
[? ]
A.同时增大
B.同时减小
C.v1增大,v2减小
D.v1减小,v2增大?
参考答案:A
本题解析:
本题难度:一般
5、填空题 (8分)科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105Pa、反应时间3h):
T/K
| 303
| 313
| 323
| 353
|
NH3生成量/(10-6mol)
| 4.8
| 5.9
| 6.0
| 2.0
|
相应的热化学方程式如下:
N2(g)+3H2O(l)====2NH3(g)+ O2(g)?ΔH
O2(g)?ΔH =+765.2kJ·mol-1
=+765.2kJ·mol-1
回答下列问题:
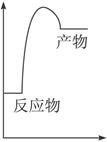
(1)右图是上述反应在无催化剂情况下反应过程中体系能量变化示意图,请在图中画出在有催化剂情况下反应过程中体系能量变化示意图。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议:?。
(3)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为 。计算
。计算
①该条件下N2的平衡转化率是?;
②该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数为?
N2(g)+3H2(g)的平衡常数为? ?。
?。
③若温度不变,减小容器体积,则平衡向---------------------------移动,c(NH3)将--------------------
c(N2)将----------------------(填增大、减小或不变)?
参考答案:(1)画图略。(2分)
(2)升高温度,增大反应物N2的浓度,不断移出生成物(2分)
(3)66 .7%(2分)?0.005(2分)
.7%(2分)?0.005(2分)
本题解析:(1)作图要点:①催化剂 可降低反应的活化能,但这对各反应前后能量变化并不产生任何影响。
可降低反应的活化能,但这对各反应前后能量变化并不产生任何影响。
②该反应为吸热反应,所以反应物的总能量要低于生成物的总能量。
(2)该反应的正反应是吸热反应,升高温度,使化学平衡向正反应方向移动,从而增大NH3的生成量,升高温度也能提高反应速率;增大反应物N2的浓度,加快反应速率,并使化学平衡向右移动;不断移出生成物,使平衡向右移动,增大NH3的生成 91EXAm.org量。
(3)由三行式法计算可知,起始时,c(N2)=0.3mol·L-1。平衡时,c(N2)=0.1 mol·L-1;?c(H2)=0.2? mol·L-1;c(NH3)=0.4? mol·L-1。
①所以N2的平衡转化率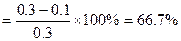 。
。
④?反应2NH3(g)====N2(g)+3H2(g)的平衡常数 。
。
本题难度:一般