1、选择题 (08郑州质量预测,9)电动自行车由于灵活、快捷、方便,已成为上班族的主要代步工具,其电源常用铅蓄电池,反应原理为:PbO2+Pb+2H2SO4 ?2PbSO4+2H2O?下列叙述正确的是(?)
?2PbSO4+2H2O?下列叙述正确的是(?)
A.放电时PbO2是电池的负极,电解质溶液的密度逐渐减小
B.放电时负极的电极反应式为:Pb+SO42--2e-=PbSO4↓
C.电池充电时,PbO2得电子被氧化
D.电池充电时,阴极电极反应式为:PbSO4+2H2O-2e-=PbO2+SO42-+4H-
参考答案:B
本题解析:本题考查原电池和电解池,中等提。放电时PbO2发生还原反应,为电池的正极,电解质溶液的密度逐渐减小,A错;充电时,PbSO4被氧化,PbO2为氧化产物,C错;充电时阴极发生还原反应:PbSO4+2e-=Pb+SO42-,D错。
本题难度:一般
2、选择题 现在所见的燃料电池主要有如下的四种,下面是这四种燃料电池的工作原理示意图,其中正极的反应产物为水的是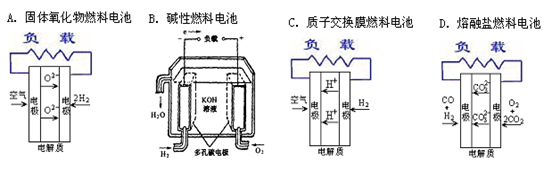
参考答案:C
本题解析:A的正极反应式为: ;B的正极反应式为:
;B的正极反应式为: ;C的电极反应式为:
;C的电极反应式为: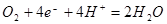 ;D的正极反应式为:
;D的正极反应式为: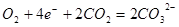 ;所以,正确选项为C;
;所以,正确选项为C;
本题难度:一般
3、选择题 甲烷燃料电池(电解质是KOH溶液)的总反应为:CH4+2KOH+2O2=K2CO3+3H2O.?下列有关的说法中不正确的是( )
A.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
B.该燃料电池在使用过程中电解质溶液的浓度和性质均发生变化
C.负极反应式:CH4+3H2O-8e-=CO32-+7H+
D.正极反应式:2O2+4H2O+8e-=8OH-
参考答案:A、在燃料电池工作时,化学能大多数转化为电能,甲烷燃烧伴随着光能和热能,甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大,故A正确;
B、燃料电池在使用过程中发生电池反应:CH4+2KOH+2O2=K2CO3+3H2O,电解质氢氧化钾被消耗,生成碳酸钾溶液,电解质溶液的浓度和性质均发生变化,故B正确;
C、甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,故C错误;
D、通入氧气的一极为原电池的正极,发生还原反应,电极反应式为2O2+4H2O+8e-=8OH-,故D正确.
故选C.
本题解析:
本题难度:简单
4、选择题 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法中错误的是( )
A.电池工作时,锌失去电子,锌是负极
B.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
C.电池负极的电极反应式为:Zn-2e-+2OH-=Zn(OH)2
D.电池工作时,电子由负极流向正极,溶液中OH-向正极移动,K+、H+向负极移动
参考答案:A、原电池工作原理是,负极失电子,发生氧化反应,故A正确;
B、由Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)可知,65gZn反应转移电子为2mol,则6.5gZn反应转移0.2mol电子,故B正确;
C、负极失电子,发生氧化反应,所以负极的电极反应式为:Zn-2e-+2OH-=Zn(OH)2,故C正确;
D、电池工作时,电子由负极流向正极,根据异性电荷相吸,溶液中K+、H+向正极移动,OH-向负极移动,故D错误;
故选D.
本题解析:
本题难度:简单
5、选择题 锂电池广泛用于手机、数码相机及便携式电脑中.此种锂电池的负极通常由金属锂构成,正极由二氯亚砜(SOCl2)和碳材料构成.总反应为:4Li+2SOCl2=4LiCl+S+SO2↑,此种锂电池是一次电池,在放电时有气体产生.以下说法中正确的是( )
A.放电时电池内部Li+向负极移动
B.放电过程中,电池负极材料的质量减少
C.放电时电池正极反应为:2SOCl2+4e-=SO2+S+4Cl-
D.放电时每转移4mol电子,有2mol?S被还原
参考答案:A、放电时电池内部Li+向正极移动,故A错误;
B、放电过程中,电池负极材料为锂,失电子发生氧化反应,质量减少,故B正确;
C、放电时电池负极反应为:4Li-4e-=4Li+,总反应为:4Li+2SOCl2=4LiCl+S+SO2↑,两式相减得到正极反应为:2SOCl2+4e-=SO2+S+4Cl-,故C正确;
D、总反应为:4Li+2SOCl2=4LiCl+S+SO2↑,放电时每转移4mol电子,有1mol S元素被还原,故D错误;
故选BC.
本题解析:
本题难度:简单