1、选择题 下列离子方程式正确的是
A.钠与水反应 2Na+2H2O = 2Na+ + 2OH- + H2↑
B.氢氧化镁与硫酸溶液反应 OH-+H+=H2O
C.碳酸钙与醋酸溶液反应: CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
D.铁与稀硫酸反应 2Fe+6H+=2Fe3++3H2↑
参考答案:AC
本题解析:A:正确
B:氢氧化镁不溶于水,不能拆为离子,不正确
C:正确
D:生成的应该是亚铁盐,不正确
答案为AC
本题难度:一般
2、填空题 (1)常温下,0.1 mol·L-1的醋酸和pH=1的醋酸各100 mL分别与足量的锌粒反应,产生的气体前者比后者________(填“多”、“少”或“相等”)。
(2)25℃时,将pH=5的氯化铵溶液稀释100倍,稀释后溶液的pH为________(填字母,下同)。
A.5? B.7? C.3~5之间? D.5~7之间
(3)25℃时,向0.1 mol·L-1的醋酸溶液中加入少量醋酸钠晶体,当晶体溶解后测得溶液的pH将________,醋酸的电离度??,醋酸的电离平衡常数?,水的电离程度?。
A.增大? B.减少C.不变? D.无法确定
(4)已知某温度下0.01 mol/L HCl溶液中由水电离的c(H+)=10-11 mol/L,则KW=________;若在此温度下将pH=a的NaOH溶液与pH=b的盐酸按体积比1∶100混合后二者刚好完全反应,a与b应满足的关系为________。
(5)室温下NaHCO3溶液的PH ?7(填>、<或=),原因是(用离子方程式表示)??,NaHCO3溶液中离子浓度的大小顺序是?
参考答案:(1)少?(2)D?(3)A B C A? (4) 10-13 , a+b=15
(5) ﹥ , HCO3-+H2O H2CO3+OH-? C(Na+)﹥C(HCO3-)﹥C(OH-)﹥C(H+)﹥C(CO32-)
H2CO3+OH-? C(Na+)﹥C(HCO3-)﹥C(OH-)﹥C(H+)﹥C(CO32-)
本题解析:(1)pH=1的醋酸的物质的量浓度要远大于0.1 mol·L-1,与足量的锌粒反应,产生的氢气要多。
(2)弱酸性溶液稀释后酸性减弱,pH升高,但不会等于或超过7
(3)CH3COOH  ?CH3COO— + H+
?CH3COO— + H+
向醋酸溶液中加入少量醋酸钠晶体,平衡左移,电离度减小, H+减小,酸性减小,水的电离程度增大,但电离平衡常数只与温度有关,是不会改变的
(4)某温度下0.01 mol/L HCl溶液中由水电离的c(H+)=10-11 mol/L,则溶液中的c(OH—)=10-11 KW=10-11×10-2 =10-13;由公式:a+b=13+lg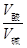 ,即a+b=15
,即a+b=15
(5)考查了酸式盐类的水解,较常见。
本题难度:一般
3、填空题 现有CO32-、K+、SO42-、Cl-、Al3+、Fe3+、HCO3-、Ba2+八种离子,试按要求填空:
(1)只能与H+大量共存,不能与OH-大量共存的有______________________。
(2)只能与OH-大量共存,不能与H+大量共存的有______________________。
(3)既能与H+大量共存,又能与OH-大量共存的有_______________________。
(4)既不能与H+大量共存,又不能与OH-大量共存的有____________________。
参考答案:(1)Al3+、Fe3+?(2)CO32-(3)K+、SO42-、Cl-、Ba2+?(4)HCO3-
本题解析:(1)Al3+、Fe3+只能与H+大量共存,不能与OH-大量共存。
(2)CO32-只能与OH-大量共存,不能与H+大量共存。
(3)既能与H+大量共存,又能与OH-大量共存的有K+、SO42-、Cl-、Ba2+。
(4)既不能与H+大量共存,又不能与OH-大量共存的有HCO3-。
点评:该题是高考中的常见题型和考点,属于基础性试题的考查。试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和发散思维能力。该题的关键是记住常见与氢离子和OH-反应的离子,然后结合题意灵活运用即可。
本题难度:一般
4、选择题 下列各组离子能在溶液中大量共存的是( )
A.Na+、Mg2+、Cl-、OH-
B.H+、Ca2+、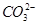 、
、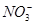
C.Cu2+、K+、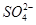 、
、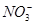
D.Na+、H+、OH-、Ca2+
参考答案:C
本题解析:A中Mg2+和OH-反应生成氢氧化镁白色沉淀;B中H+和CO32-反应生成CO2和水;D中H+和OH-反应生成水,都不能大量共存,所以正确的答案选C。
点评:离子间如果发生化学反应,则不能大量共存,反之是可以的。离子不能大量共存的一般情况是(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质)。(2)能生成微溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-)。(3)能完全水解的离子之间,如多元弱酸和弱碱盐的阴、阳离子(如:Al3+, Fe3+与CO32-、HCO3-、AlO2-、ClO-,S2-等)。(4)能发生氧化还原反应的离子之间(如:Fe 、H+、NO3-;S2-、ClO-;S2-、 Fe3+等)。(5)能发生络合反应的离子之间(如 Fe3+和 SCN-)。解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或 OH-。(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在。(3)溶液的具体反应条件,如“氧化还原反应”“加入铝粉产生氢气” 。(4)是“可能”共存,还是“一定”共存。
本题难度:一般
5、填空题 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺如下:
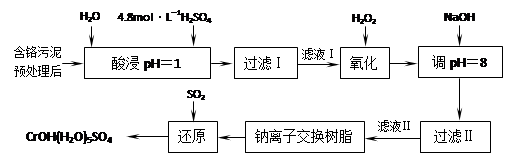
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L―1的浓硫酸配制250 mL 4.8 mol·L―1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需???。
(2)酸浸时,为了提高浸取率可采取的措施有???、
???。(写出两个措施)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72―,写出此反应的离子方程式:
???。?
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子
| Fe3+
| Mg2+
| Al3+
| Cr3+
|
开始沉淀时的pH
| 2.7
| ——
| ——
| ——
|
沉淀完全时的pH
| 3.7
| 11.1
| 8
| 9(>9溶解)
|
?
加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有?;但溶液的pH不能超过8,其理由是?。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是???。
(6)写出上述流程中用SO2进行还原的化学方程式?。
参考答案:(1)250mL容量瓶(1分)、量筒(1分)
(2)升高反应温度、增大固体颗粒的表面积、加快搅拌速度等(3点中答到2点即给2分)
(3)2Cr3+ + 3H2O2 + H2O =? Cr2O72—+ 8H+(2分)
(4)Na+、Mg2+、Ca2+(2分)
pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(III)回收与再利用(2分)
(5)Ca2+、Mg2+(2分)
(6)3SO2 + 2Na2CrO4 + 12H2O = 2CrOH(H2O)5SO4↓+ Na2SO4 + 2NaOH (2分,
或3SO2 + 2CrO42- + 12H2O = 2CrOH(H2O)5SO4↓+ SO42- + 2OH-)
本题解析:(1)考查物质的量浓度的配制。根据所给的仪器可知,好缺少250ml容量瓶和量筒。
(2)考查外界条件对反应速率的影响。可从温度,浓度和接触面积等角度进行考虑。
(3)考查氧化还原反应方程式的配平,依据得失电子守恒进行配平。
(4)根据沉淀时的pH值可以判断,当pH=8时,溶液中的Fe3+、Al3+已经以氢氧化物沉淀的形成析出,溶液中的阳离子主要还有Na+、Mg2+、Ca2+。因为pH太高,会溶解氢氧化铝沉淀,影响其后续实验的分离和提纯。
(5)根据钠离子交换树脂的反应原理可知,滤液中的Ca2+、Mg2+将被交换而除去。
(6)根据物质反应前后的变化可知二氧化硫是用来还原溶液中的CrO42―,其还原产物是CrOH(H2O)5SO4,然后根据得失电子守恒配平即可。
本题难度:一般