1、选择题 取等物质的量的镁粉和铝粉混合,再将混合物平均分为四份,分别加入足量的下列溶液中,充分反应后放出氢气最多的是
A.3mol/L的HCl
B.4mol/L的HNO3
C.8mol/L的NaOH
D.18mol/L的H2SO4
参考答案:A
本题解析:
正确答案A
BD是氧化性酸,无氢气产生;A项Mg和Al均产生H2.C选项只有铝反应,产生H2少些。
本题难度:一般
2、选择题 如图示意铝在氧气中燃烧的实验,铝条点燃后,为维持燃烧继续,正确的操作是
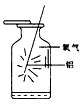
[? ]
A.铝条应始终置于集气瓶瓶口位置
B.迅速将铝条插入集气瓶接近瓶底位置
C.将铝条从瓶口位置慢慢伸向瓶底位置
D.铝条应不断上下移动
参考答案:C
本题解析:
本题难度:简单
3、选择题 下列物质能与金属镁发 生反应,并产生氢气的是
生反应,并产生氢气的是
A.氯化铵溶液
B.浓硝酸
C.热的苯
D.氯化铝溶液
参考答案:AD
本题解析:略
本题难度:简单
4、填空题 (16 分)某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:
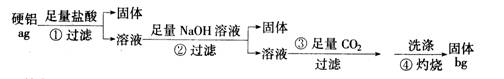
(1)补全上述①②③④各步反应的离子方程式
①?Mg+2H+===Mg2++H2↑ , ___________________________
②?_______________________, _______________________
Mg2++OH-===Mg(OH)2↓
③ ___________________________________
CO2+H20+ A102-===Al(OH)3↓+3HCO3-
④2A1(OH)3===Al203+H20
(2)该样品中铝的质量分数是(?)
(3)第②步中加入Na0H溶液不足时,会使测定结果(?)
第④步中的沉淀没有用蒸馏水洗涤时,会使测定结果(?)
第④步对沉淀灼烧不充分时,会使测定结果(?)
A.偏高? B.偏低? C.不影响
参考答案:(1)2Al+6H+ ="==2" A13++3 H2↑ , H++OH-="==" H20
A13++ 4OH—===A102-+2H20, CO2+ OH-="==" HCO3—
(2)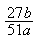
(3)B,A,A
本题解析:略
本题难度:简单
5、填空题 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
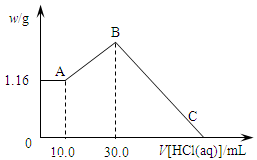
(1)A点的沉淀物的化学式为?。
(2)写出A点至B点发生反应的离子方程式:?。
(3)原混合物中NaOH的质量是?g,C点(此时沉淀恰好完全溶解)HCl溶液的体积为?mL。
参考答案:(1)Mg(OH)2? (2)AlO2-+H++H2O=Al(OH)3↓ (3)5.20? 130.0
本题解析:(1)向所得浊液中,逐滴加入1.00mol/L盐酸,由加入盐酸的体积和生成沉淀的质量关系图分析:①0~10ml,随盐酸的体积增加,生成沉淀的质量不变,说明氢氧化钠过量,加入的盐酸与氢氧化铝先反应,方程式为NaOH+HCl=NaCl+H2O。因此A点沉淀是Mg(OH)2,其质量是1.16g,物质的量n=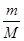 =
=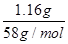 =0.02mol。则根据原子守恒可知原混合物中氯化镁的物质的量=0.02mol。
=0.02mol。则根据原子守恒可知原混合物中氯化镁的物质的量=0.02mol。
(2)NaOH、AlCl3、MgCl2组成的混合物,溶于足量水发生反应是:MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+4NaOH=NaAlO2+3NaCl+2H2O。NaOH过量,溶液是NaCl、NaAlO2和NaOH的混合液,则A~B阶段发生反应是:NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,离子方程式是:H2O+AlO2-+H+=Al(OH)3↓。
(3)A~B阶段消耗盐酸的物质的量=(0.03L-0.01L)×1.0mol/L=0.02mol,则根据方程式NaAlO2+HCl+H2O=Al(OH)3↓+NaCl可知生成氢氧化铝的物质的量=0.02mol。所以根据原子守恒可知原混合物中氯化铝的物质的量是0.02mol。B点沉淀达到最大值,此时的沉淀是氢氧化镁和氢氧化铝的混合物。而溶液则恰好是氯化钠溶液。根据氯离子守恒可知氯化钠的物质的量=0.03L×1.00mol/L+0.02mol×2+0.02mol×3=0.13mol。所以根据钠离子守恒可知,氢氧化钠的物质的量也是0.13mol,因此氢氧化钠的质量m=n· M=40g/mol×0.13mol=5.2g。B~C阶段加入的盐酸开始溶解氢氧化铝和氢氧化镁,此时反应的方程式为Mg(OH)2+2HCl=MgCl2+2H2O;Al(OH)3+3HCl=AlCl3+3H2O。根据氢氧化镁和氢氧化铝均是0.02mol可知,该阶段消耗盐酸的物质的量是0.02mol×2+0.02mol×3=0.10mol,其体积是0.10mol÷1mol/L=0.1L=100ml,所以C点(此时沉淀恰好完全溶解)HCl溶液的体积为30ml+100ml=130ml。
本题难度:一般