1、选择题 1gH2燃烧生成液态水放出142.9KJ的热量,表示该反应的热化学方程式正确的是(?)
A.2H2(g)+O2(g)=2H2O(l) ΔH=-142.9kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
C.2H2+O2=2H2OΔH=-571.6kJ·mol-1
D.H2(g)+1/2O2(g)=H2O(g)ΔH=-285.8kJ·mol-1
参考答案:B
本题解析:略
本题难度:一般
2、填空题 (16分) 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
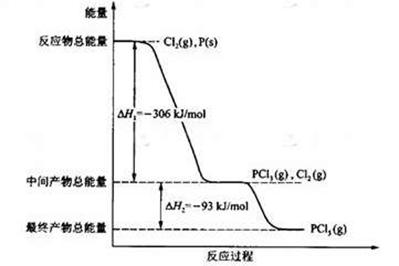
根据上图回答下列问题:(1)P和Cl2反应生成PCl3的热化学方程式是
?;
(2)PCl5分解成PCl3和Cl2的热化学方程式是
?;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率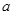 1等于?;若反应温度由T1升高到T2,平衡时PCl5的分解率为
1等于?;若反应温度由T1升高到T2,平衡时PCl5的分解率为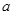 2,
2,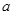 2?
2? 1(填“大于”、“小于”或“等于”);
1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,现将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是?
?;
(4)P和Cl2分两步反应生成1 mol PCl5的△H 3=?,P和Cl2一步反应生成1 mol PCl5的△H 4?△H 3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是
?。
参考答案:(16分)(1) ?Cl2(g)+ P(s)= PCl3(g)?△H =-306kJ/mol?
?Cl2(g)+ P(s)= PCl3(g)?△H =-306kJ/mol?
(2)PCl5(g)= PCl3(g)+ Cl2(g)?△H =93kJ/mol?
25%?大于?
(3)两步反应均为放热反应,降温有利于提高产率,防止产物分解?
(4)-399kJ/mol?等于?
(5)PCl3+4H2O=H3PO4+5HCl
本题解析:(1)△H1是磷和氯气反应生成PCl3的热效应,故热化学方程式为: ?Cl2(g)+ P(s)= PCl3(g) △H =-306kJ/mol; (2)PCl5分解反应物的总能量低于生成物的总能量,故为吸热反应,△H正值,故为PCl5(g)= PCl3(g)+ Cl2(g) △H =93kJ/mol;转化量为0.2mol,转化量除以起始量0.8mol求得转化率;分解反应为吸热反应,升高温度,平衡向右移动,转化率增大;(3)两步反应均是放热反应,故降温提高产率;(4)△H3=△H1+△H2,故为-399kJ/mol;根据盖斯定律可得不管反应分几步完成,总热效应不变;(5)PCl3中磷显正价,氯显负价,氯结合水电离出的氢离子生成氯化氢,磷结合水电离出的氢氧根离子生成磷酸。
?Cl2(g)+ P(s)= PCl3(g) △H =-306kJ/mol; (2)PCl5分解反应物的总能量低于生成物的总能量,故为吸热反应,△H正值,故为PCl5(g)= PCl3(g)+ Cl2(g) △H =93kJ/mol;转化量为0.2mol,转化量除以起始量0.8mol求得转化率;分解反应为吸热反应,升高温度,平衡向右移动,转化率增大;(3)两步反应均是放热反应,故降温提高产率;(4)△H3=△H1+△H2,故为-399kJ/mol;根据盖斯定律可得不管反应分几步完成,总热效应不变;(5)PCl3中磷显正价,氯显负价,氯结合水电离出的氢离子生成氯化氢,磷结合水电离出的氢氧根离子生成磷酸。
本题难度:一般
3、选择题 下列关于化学反应和能量变化关系的描述中,说法不正确的是
A.放热反应,不必加热就一定能发生
B.化学反应中一定有能量变化
C.吸热反应不一定需要加热也能发生
D.热化学方程式中,热效应数值与反应物的物质的量多少有关
参考答案:A
本题解析:放热反应,不一定不加热,吸热反应也不一定要加热。比如说燃烧反应都要加热。
本题难度:一般
4、选择题 下列说法正确的是(?)?
A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量。
B.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据。
C.书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态。
D.凡是化合反应都是放热反应,分解反应都是吸热反应。
参考答案:C
本题解析:书写和应用热化学方程式时必须注意以下几点:
(1)反应热与温度和压强等测定条件有关,所以书写时指明反应时的温度和压强(25℃、101kPa时,可以不注明)
(2)各物质化学式右侧用圆括弧()表明物质的聚集状态。可以用g、l、s分别代表气态、液态、固态。
(3)热化学方程式中化学计量数只表示该物质的物质的量,不表示物质分子个数或原子个数,因此,它可以是整数,也可以是分数。
(4)热化学方程式是表示反应已完成的数量。由于△H与反应完成物质的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,当反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
化合反应不一定都是放热反应,分解反应不一定都是吸热反应。
点评:理解热化学方程式的书写(各物质化学式右侧用圆括弧()表明物质的聚集状态)、含义(热化学方程式中化学计量数只表示该物质的物质的量)。
本题难度:一般
5、选择题 将1mol?A(g)和2mol?B(g)置于2L某密闭容器中,在一定温度下发生反应:A(g)+B(g)?C(g)+D(g),并达到平衡.C的体积分数随时间变化如图Ⅰ中曲线b所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是( )
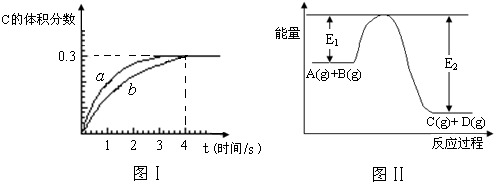
A.在上述反应体系中加入催化剂,化学反应速率增大,E1和E2均减小
B.该温度下,反应的平衡常数数值约为7.36;若升高温度,该反应的平衡常数减小
C.恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中a曲线进行
D.反应在第4秒钟达到化学平衡状态,此时以A表示的化学反应速率是v(A)=0.225mol?L-1?s-1
参考答案:A、加入催化剂降低反应的活化能,则E1和E2均减小,化学反应速率增大,故A正确;
B、反应物总能量大于生成物总能量,反应放热,升高温度,平衡向逆反应方向移动,平衡常数减小,故B正确;
C、缩小反应容器的体积,压强增大,反应速率增大,方程式中气体的化学计量数反应前后相等,增大压强平衡不移动,故C正确;
D、根据反应方程式的化学计算量数关系可知,VA=VC=3×0.3mol2L4s0.1125mol?L-1?s-1,故D错误;
故选D.
本题解析:
本题难度:简单