1、选择题 亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但遇酸性溶液发生分解: 5HClO2 = 4ClO2↑ + H+ + Cl-+ 2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,一段时间产生气体速度较快,速度变化的原因是
[? ]
A.逸出ClO2使生成物浓度降低
B.酸使亚氯酸的氧化性增强
C.溶液中的H+起催化作用
D.溶液中的Cl-起催化作用
参考答案:D
本题解析:
本题难度:一般
2、实验题 I.下列四支试管中,过氧化氢分解的化学反应速率最大的是?
试管
| 温度
| 过氧化氢浓度
| 催化剂
|
a
| 室温(25℃)
| 12%
| 有
|
b
| 水浴加热(50℃)
| 4%
| 无
|
c
| 水浴加热(50℃)
| 12%
| 有
|
d
| 室温(25℃)
| 4%
| 无
|
II.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号
| 反应物
| 催化剂
|
①
| 10mL2% H2O2溶液
| 无
|
②
| 10mL5% H2O2溶液
| 无
|
③
| 10mL5% H2O2溶液
| 1mL0.1mol·L-1FeCl3溶液
|
④
| 10mL5% H2O2溶液+少量HCl溶液
| 1mL0.1mol·L-1FeCl3溶液
|
⑤
| 10mL5% H2O2溶液+少量NaOH溶液
| 1mL0.1mol·L-1FeCl3溶液
|
(1)实验①和②的目的是____________________________。
(2)写出实验③的化学反应方程式?。
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。
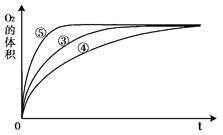
分析上图能够得出的实验结论是?_________________________。
参考答案:I.c(2分)
II.(1)探究浓度对反应速率的影响?(2分)
(2)2H2O2 O2↑+2H2O(2分)
O2↑+2H2O(2分)
(3)碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率 (2分)
本题解析:I温度越大,化学反应速率越大,催化剂可以提高化学反应的反应速率,所以过氧化氢分解的化学反应速率最大的是c;
II.(1)①和②中所以的过氧化氢的浓度不同,其他条件相同,所以①和②的目的是探究浓度对反应速率的影响;(2)实验③采用了FeCl3作为催化剂,所以实验③的化学反应方程式为2H2O2 O2↑+2H2O;有图可以知道加入少量NaOH溶液,反应很快结束,而加入少量HCl溶液则反应最慢结束,所以分析该图能够得出的结论为碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率 。
O2↑+2H2O;有图可以知道加入少量NaOH溶液,反应很快结束,而加入少量HCl溶液则反应最慢结束,所以分析该图能够得出的结论为碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率 。
点评:本题通过实验的方式探究了影响化学反应速率的因素,有综合性较好,有利于培养学生的探究性思维,本题难度不大。
本题难度:一般
3、选择题 足量的Fe粉与一定量的盐酸反应,为了减慢反应速率,但又不影响产生氢气的总量,应加入下列物质中的( )
A.NaNO3溶液
B.NaCl固体
C.水
D.CuSO4
参考答案:根据发生的反应为Fe+2H+═Fe2++H2↑,则减小氢离子的浓度而不改变氢离子的物质的量即可满足减慢反应速率,但又不影响产生氢气的总量,
A、加入NaNO3溶液,Fe与硝酸根离子、氢离子发生氧化还原反应生成NO,而不生成氢气,故A错误;
B、加入NaCl固体,对反应无影响,不会减慢反应速率,故B错误;
C、加入水,氢离子的浓度减小,但氢离子的物质的量没有变化,则反应速率减慢,但又不影响产生氢气的总量,故C正确;
D、加入CuSO4,构成Fe、Cu、盐酸原电池,加快反应速率,故D错误;
故选C.
本题解析:
本题难度:一般
4、选择题 足量Zn粉与50ml、 0.1mol/L的稀硫酸充分反应。为了减慢此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加Na2SO4溶液;②改用50ml、0.1mol/L的稀盐酸;③改用50ml、0.05mol/L的硝酸;
④加适量固体醋酸钠;⑤减压;⑥冰水浴;⑦加NaCO3溶液;⑧纯Zn改为不纯的Zn
A.①④⑥
B.③⑤⑥⑦⑧
C.①②⑤⑥
D.全部