1、选择题 下列各种关系的比较,均正确的是( )
A.熔沸点:Li>Na>K>Bb;SiO2>NaCl>Na
B.酸性:H3PO4>H3AsO4;HClO>H2CO3
C.微粒半径:K+>Na+>Mg2+>Ba2+
D.热稳定性:H2O>NH3>PH3>SiH4;SnH4>GeH4>SiH4>CH4
参考答案:A.熔沸点一般为原子晶体>离子晶体>金属晶体,碱金属的熔沸点随原子序数的增大而减小,所以熔沸点为Li>Na>K>Bb,SiO2>NaCl>Na,故A正确;
B.非金属性P>As,所以酸性为H3PO4>H3AsO4,由强酸制弱酸的反应可知,酸性为HClO<H2CO3,故B错误;
C.电子层越多,离子半径越大,有相同电子排布的离子,原子序数大的离子半径小,
则微粒半径为Ba2+>K+>Na+>Mg2+,故C错误;
D.非金属性越强,气态氢化物越稳定,所以热稳定性为H2O>NH3>PH3>SiH4,SnH4<GeH4<SiH4<CH4,故D错误;
故选A.
本题解析:
本题难度:一般
2、选择题 核反应中会产生I-131,而我们生活中常见的是含I-127的碘及碘的化合物,下列说法正确的是?
[? ]
A.I-131和I-127互为同位素 ?
B.食盐中含碘的物质是碘化钾 ?
C.分离氯化钠和碘单质可以用过滤的方法 ?
D.I-131和I-127化学性质不同
参考答案:A
本题解析:
本题难度:简单
3、推断题 (三选一)【物质结构与性质】
原子序数依次递增的A、B、C、D、E是周期表中前30号元素。已知A的最外层电子数是其内层电子数的2倍;A与C形成的常见化合物之一是主要的温室气体;D与A同主族,其单质在同周期元素所形成的单质中熔点最高;E原子M能?层为全充满状态,且核外的未成对电子只有一个。请回答下列问题:
(1)B在周期表中的位置是___________,该主族元素的气态氢化物中,沸点最低的是__________(填化学式)。
(2)根据等电子原理分析,BC2+?中B原子的轨道杂化类型是____________。
(3)五种元素中,电负性最大与最小的两种非金属元素形成的化合物在常温下是晶体,其晶体类型是____________。
(4)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5…,推测D元素的电离能突增应出现在第______电离能。
(5)A的一种相对分子质量为28的氢化物,其分子中σ键与π键的个数之比为________;A能形成多种常见单质,在熔点最低的单质中,每个分子周围紧邻的分子数目为___________;?
(6)E的基态原子有_____种形状不同的原子轨道;E2+?的价电子排布式为_______;下图_______(填甲、乙或丙)表示的是E晶体中微粒的堆积方式。
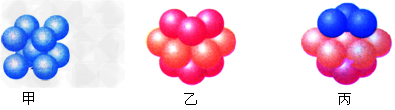
参考答案:(1)第二(或2)周期?第ⅤA(或五主、Ⅴ主)族;PH3
(2)sp
(3)原子晶体
(4)五(或I5)
(5)?5:1;?12
(6)3;3d9;丙
本题解析:
本题难度:一般
4、选择题 下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )

选项
| a
| b
| c
|
A
| Al
| AlCl3
| Al(OH)3
|
B
| HNO3
| NO
| NO2
|
C
| Si
| SiO2
| H2SiO3
|
D
| NH3
| NO2
| NO
|
?
参考答案:B
本题解析:A项,Al(OH)3→Al的转化必须经过Al(OH)3→Al2O3→Al这两步;C项,SiO2→H2SiO3必须经过两步SiO2→Na2SiO3→H2SiO3,H2SiO3→Si也必须经过两步H2SiO3→SiO2→Si;D项,NH3→NO2必须经过两步NH3→NO→NO2。
本题难度:一般
5、选择题 元素周期律的发现对新元素的发现、化学理论和实验等研究工作起到了指导作用。周期律揭示的规律包括以下内容中的
[? ]
①元素的性质随相对原子质量的递增作周期性变化
②元素的性质是元素原子序数的周期性函数
③事物的量变可以引起质变
④元素性质的递变只取决于其核电荷数的递变,与原子结构无关
A.①②
B.①③
C.①④
D.①②③④
参考答案:B
本题解析:
本题难度:一般