1、推断题 A是自然界存在最广泛的IIA族元素,常以化合物F存在。从单质A起始发生的一系列化学反应可由下图表示:

请回答下列问题:
(1)A与水反应的化学方程式为_________,E与水反应的化学方程式为_____;
(2)F的化学式为_________,G和D的电子式分别为_________和__________;
(3)D与H反应可能生成的盐有_____________ (填化学式);
(4)实际生产中,可由F为原料制备单质A,简述一种制备方法______________。
参考答案:(1)Ca+2H2O=Ca(OH)2+H2↑;NaH+H2O=NaOH+H2↑
(2)CaCO3;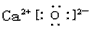 ?;
?;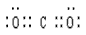
(3)Na2CO3,NaHCO3
(4)将CaCO3与盐酸反应转化为CaCl2,然后电解熔融的CaCl2固体就制得单质钙。
本题解析:
本题难度:一般
2、填空题 现有X、Y、Z、W四种元素,其原子序数依次递增.已知有如下情况:
①X、Y、Z的单质在常温下均为气体.
②X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色.
③XZ极易溶于水,在水溶液中电离出X+和Z-.XZ的水溶液可使石蕊试液变红.
④两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体.
⑤Z的单质溶于X2Y中,所得溶液具有漂白作用.
⑥由Y、Z、W三种元素组成的化合物M受热催化分解,可制得元素Y的单质.
请完成下列问题:
(1)化合物M的化学式为______,1mol M中含有的电子的物质的量为______mol.
(2)用化学方程式表示Z单质的实验室检验方法______.
(3)写出Z的单质溶于X2Y中反应的化学方程式:______,若该反应中有2mol电子发生转移,则参加反应的Z单质在标况下的体积为______L.
参考答案:现有X、Y、Z、W四种元素,其原子序数依次递增,
由①X、Y、Z的单质在常温下均为气体、②X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色、③XZ极易溶于水,在水溶液中电离出X+和Z-.XZ的水溶液可使石蕊试液变红可知,X为H,Z为Cl,
由④两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体,则Y为O,
⑤Z的单质溶于X2Y中,所得溶液具有漂白作用,反应生成HClO具有漂白性,
⑥由Y、Z、W三种元素组成的化合物M受热催化分解,可制得元素Y的单质,则W为K,M为KClO3,
(1)M为KClO3,1molM含电子为1mol×(19+17+8×3)=60mol,故答案为:KClO3;60;?
(2)利用湿润的淀粉KI试纸检验氯气,则Z单质的实验室检验方法为Cl2+2KI=2KCl+I2,故答案为:Cl2+2KI=2KCl+I2;
(3)Z的单质溶于X2Y中反应的化学方程式为Cl2+H2O=HClO+HCl,有2mol电子发生转移,则参加反应的Z单质在标况下的体积为2mol×22.4L/mol=44.8L,
故答案为:Cl2+H2O=HClO+HCl;44.8.
本题解析:
本题难度:一般
3、实验题 (9分)某非金属单质A经如下图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题:
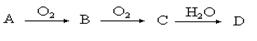
(1)若A常温下为淡黄色固体,B是有刺激性气味的无色气体。
①A、D的化学式分别为:A??D?
②工业生产中大量排放的B气体被雨水吸收后形成?而污染环境。
③写出B→C反应的化学方程式:?
(2)若A在常温下为气体,C是红棕色气体。
①A的电子式为?,C的化学式为??
②写出C→D反应的化学方程式:?
参考答案:① A? S? D? H2SO4? ②?酸雨
③2SO2+O2 2SO3(方程式每空2分,其余每空1分共9分)
2SO3(方程式每空2分,其余每空1分共9分)
(2)①? ?;? NO2?②3 NO2+ H2O= 2HNO3+ NO
?;? NO2?②3 NO2+ H2O= 2HNO3+ NO
本题解析:(1)若A是一种黄色单质固体,则A是S单质,属于B是二氧化硫,C是三氧化硫,则B→C的化学方程式为2SO2+O2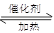 2SO3。
2SO3。
(2)①若A在常温下为气体,C是红棕色气体,则A应该是氮气,C是NO2,B是NO。
②NO2与水反应的化学方程式是3 NO2+ H2O= 2HNO3+ NO。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题难易适中,基础知识,侧重对学生基础知识的巩固个训练。该类试题需要注意的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:困难
4、简答题 已知A、B、D、H?是中学范围内的常见的单质,J为蓝色溶液.相互转化关系如图所示(部分产物及反应条件已略去),试回答有关问题:
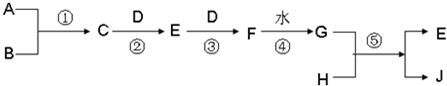
(1)若A为气体,B为固体时,已知反应:C+D→E+H2O,E是一种大气污染物,且将C与E混合可生成淡黄色的B,写出C和E反应的化学方程式:______,其中氧化产物与还原产物的物质的量之比为______
(2)若A、B均为气体,当将C和G的浓溶液相互接触时会产生白烟,检验白烟中含有的阳离子的方法是:______写出反应②的化学方程式______.
参考答案:(1)是一种大气污染物,且将C与E混合可生成淡黄色的B,则E为SO2,C、D与E发生:2H2S+SO2═3S↓+2H2O,生成S为淡黄色,则B为S,C为H2S,F为SO3,G为H2SO4,J为蓝色溶液,应为硫酸铜溶液,H为Cu,在反应2H2S+SO2═3S↓+2H2O中,H2S被氧化物生成S,SO2被还原生成S,所以氧化产物与还原产物的物质的量之比为2:1,
故答案为:2H2S+SO2═3S↓+2H2O;2:1;
(2)能与铜反应的酸H2SO4有和HNO3,本题中G应为HNO3,C和G的浓溶液相互接触时会产生白烟,则C为NH3,D为O2,E为NO,F为NO2,则C和G的浓溶液相互接触时会产生白烟为NH4O3,检验时NH4+,可取样,溶于水,加入烧碱共热,用润湿的红色石蕊试纸检验观察到试纸变蓝,反应②为NH3被氧气氧化为NO的反应,为工业制硝酸主要反应之一,
反应的化学方程式为4NH3+5O2催化剂.高温高压4NO+6H2O,
故答案为:取样,溶于水,加入烧碱共热,用润湿的红色石蕊试纸检验观察到试纸变蓝;4NH3+5O2催化剂.高温高压4NO+6H2O.
本题解析:
本题难度:一般
5、填空题 (16分). 在某澄清、透明的黄色溶液中,可能含有NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、I-?Cl-离子。进行下述实验(所加试剂均过量)。
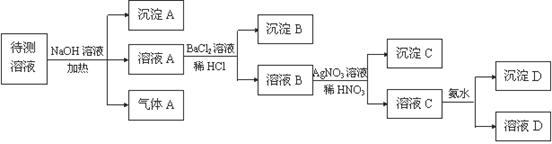
(1) 沉淀 A的化学式是?,气体A的化学式是?;
(2)待测液中一定存在?;一定不存在? _______?用离子方程式表示上述离子一定不存在的原因?。
(3)写出溶液C与过量氨水反应的离子方程式?。
(4)若气体A、沉淀A、沉淀D的物质的量各为1mol,则SO42-的物质的量为:? mol
参考答案:(1)Fe(OH)3? (1分)? NH3(1分)(2) (2分)
(2分)
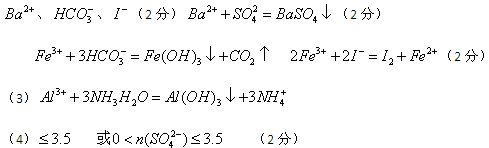
本题解析:溶液显黄色,所以一定含有铁离子。铁离子具有氧化性,能氧化碘离子生成单质碘。同时也能和HCO3-相互水解生成氢氧化铁和CO2,所以就一定不能含有HCO3-、I-。加入过量的氢氧化钠生成沉淀,所以该沉淀一定是氢氧化铁。气体应该是氨气,因此一定含有NH4+。溶液A能和盐酸酸化的氯化钡反应生成白色沉淀,所以该沉淀是硫酸钡,因此一定含有SO42-,则就一定没有Ba2+。溶液B中含有氯离子,生成沉淀C是氯化银,但由于前面用盐酸酸化,所以不能确定是否含有氯离子。溶液C能和过量的氨水反应生成沉淀,所以该沉淀只能是氢氧化铝,即原溶液中还含有Al3+。若气体A、沉淀A、沉淀D的物质的量各为1mol,则溶液中阳离子的电荷数是7mol,由于不能排除氯离子,所以SO42-的物质的量应该是小于等于3.5mol。
本题难度:一般