1、计算题 合成氨反应N2 (g) +3H2(g) 2NH3(g)在某温度下达平衡时,各物质的浓度是c(N2)=3moI·L-1,c(H2)= 9 mol·L-1.c( NH3) =4mol·L-1,求该温度时的平衡常数和N2、H2的起始浓度。
2NH3(g)在某温度下达平衡时,各物质的浓度是c(N2)=3moI·L-1,c(H2)= 9 mol·L-1.c( NH3) =4mol·L-1,求该温度时的平衡常数和N2、H2的起始浓度。
参考答案:该温度下K=7.32×10-3,起始时c(N2)=5mol·L-1, c( H2)= 15 mol·L-1。
本题解析:
本题难度:一般
2、选择题 对于平衡体系mA(g)+nB(g)===pC(g)+qD(g)? ΔH<0。下列结论中错误的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C.若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D.若改变条件使平衡体系中物质的浓度发生变化,则平衡一定发生移动
参考答案:D
本题解析:A、体积缩小一半,若平衡不移动,则浓度为2倍。现在为2.1倍,说明平衡逆向移动,逆向为体积减小方向。故A正确;
B、反应过程中因反应量等于计量系数之比,如起始量也等于计量系数之比,则转化率相等;
C、体积不变的反应,无论向何向进行,物质的量不变,正确;
D、若各物质的浓度以相同倍数改变,平衡不移动。
本题难度:简单
3、选择题 在某容积一定的密闭容器中,可逆反应:A(g)+B(g)  XC(g)符合如图像(Ⅰ)所示关系。由此推断对图(Ⅱ)的正确说法是(?)
XC(g)符合如图像(Ⅰ)所示关系。由此推断对图(Ⅱ)的正确说法是(?)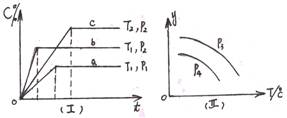

参考答案:D
本题解析:图I可得T1>T2;P2>P1;即该反应的正反应方向为放热反应,且正反应方向为气体体积缩小的反应,所以可得X=1;图II中,若P3<P4,随压强增大,平衡向正反应方向移动,生成气体的物质的量减小,混合气体的平均相对分子质量增大,A错;由于该反应的反应物和生成物都是气体且在容积固定的容器中反应,根据密度关系式 可知无论反应是否平衡,混合气体的密度均相等,B错;随温度的升高,平衡向逆反应方向移动,B的体积分数增大,C错;D正确。
可知无论反应是否平衡,混合气体的密度均相等,B错;随温度的升高,平衡向逆反应方向移动,B的体积分数增大,C错;D正确。
本题难度:一般
4、选择题 下列事实不能用勒夏特列原理解释的是(? )
A.打开汽水瓶时,有大量气泡溢出
B.在配制硫酸亚铁溶液时往往要加入一定量铁粉
C.氨水应密闭保存放置于低温处
D.实验室用排饱和食盐水的方法收集氯气
参考答案:B
本题解析:勒夏特列原理是指:如果改变影响平衡的一个条件(如浓度、温度、压强等),平衡就会向着能够减弱这种改变的方向上移动;
A可以,打开汽水瓶,压强减小,气体的溶解度减小;B不可以,在配制硫酸亚铁溶液时要加入一定量铁粉是为了防止亚铁离子被空气中的氧气氧化;C可以,氨水易挥发,且温度越高,越易挥发;D可以,排饱和食盐水的方法收集氯气可降低氯气的溶解度;
本题难度:一般
5、选择题 在2L密闭容器中,充入2molSO2和一定量的O2,发生2 SO2+ O2 2 SO3反应。进行到4mi n时,测得SO2为0.4mol,若反应进行到2min时,容器中的SO2为(?)
2 SO3反应。进行到4mi n时,测得SO2为0.4mol,若反应进行到2min时,容器中的SO2为(?)
A.1.6mol
B.1.2 mol
C.大于1.6 mol
D.小于1.2 mol
参考答案:D
本题解析:由于反应开始时反应物浓度大反应速率快所以前两分钟反应的SO2比后两分钟多,根据4mi n时,测得SO2为0.4mol,计算消耗的SO2为1.6mol,则前两分钟消耗的量大于0.8 mol,容器中的SO2小于1.2 mol,答案选D.
本题难度:一般