1、选择题 将物质的量浓度都是0.1 mol·L-1的某弱酸HX溶液与NaX溶液等体积混合,下列说法错误的是
[? ]
A.若混合后溶液中c(Na+)>c(X-),说明HX的电离程度弱于X-的水解程度
B.若混合溶液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
C.混合溶液中c(HX)+c(X-)=0.2 mol·L-1
D.混合溶液中c(HX)+c(H+)=c(Na+)+c(OH-)
参考答案:C
本题解析:
本题难度:一般
2、选择题 室温时,把10mL pH=10的强碱溶液小心地加入到10mL pH=4的某酸溶液中,在完全反应后的溶液中滴入紫色的石蕊试液时,溶液显红色,则此酸为
[? ]
A.一元强酸
B.二元强酸
C.任何强酸
D.弱酸
参考答案:D
本题解析:
本题难度:一般
3、选择题 在溶液中,能够大量共存的离子组是
A.Cu2+、Cl-、Ba2+、OH-
B.K+、CO32-、Na+、Ca2+
C.K+、Ba2+、OH-、SO42-
D.Mg2+、Na+、Cl-、SO42-
参考答案:D
本题解析:分析:根据离子之间不能结合生成水、气体、沉淀,则离子能大量共存,以此来解答.
解答:A.因OH-与Cu2+结合生成蓝色氢氧化铜沉淀,则不能共存,故A错误;
B.因CO32-、Ca2+结合生成碳酸钙沉淀,则不能共存,故B错误;
C.因SO42-、Ba2+结合生成硫酸钡沉淀,则不能共存,故C错误;
D.因该组离子之间不反应,则能共存,故D选;
故选D.
点评:本题考查离子的共存问题,明确离子之间的反应及复分解反应发生的条件、常见物质的溶解性即可解答,难度不大.
本题难度:一般
4、选择题 下列各溶液中,微粒的 物质的量浓度关系正确的是
[? ]
A.0.1 mol·L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)> c(H+)>c(OH-)
?B.0.1 mol·L-1的Na2CO3溶液中:c(OH-)=c(HCO3-)+ c(H+)+c(H2CO3)
C.0.1 mol·L-1的NH4Cl溶液与0.05 mol·L-1的NaOH溶液等体积混合:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)
D.c(NH4+)相等的(NH4)2SO4溶液、NH4HSO4溶液、(NH4)2 CO3溶液和NH4Cl溶液:c[(NH4)2SO4]
参考答案:D
本题解析:
本题难度:一般
5、填空题 写电离方程式:(1)H2SO4?;
(2)NaHCO3?;?;
参考答案:(1)H2SO4=2H +?+? SO42-
(2)NaHCO3 =Na++ HCO3-;? HCO3-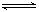 H ++ CO32-
H ++ CO32-
本题解析:H2SO4是强酸,NaHCO3是盐,均属于强电解质,故完全电离;
而HCO3-是弱酸的酸根离子,故部分电离
本题难度:一般