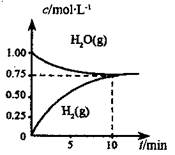
1、选择题 工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g) +H2O(g)=CO(g) +3H2(g) △H>0,在一定条件下,向体积为1L的密闭容器中充入1 mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是
A.达平衡时
B.CH4( g)的转化率为75%
C.0~10 min 内,v(CO)=0.075 mol?L-1·min-1
D.该反应的化学平衡常数K=0.1875 mol?L-1
E.当CH4(g)的消耗速率与H2O(g)的生成速率相等,反应到达平衡
参考答案:D
本题解析:试题分析:根据图像可知,反应进行到10min时达到平衡状态,氢气和水蒸气的平衡浓度均是0.75mol/L,因此消耗水蒸气的浓度是1mol/L-0.75mol/L=0.25mol/L,则:
CH4(g) +H2O(g)=CO(g) +3H2(g)
起始浓度(mol/L)? 1? 1? 0? 0
转化浓度(mol/L) 0.25? 0.25? 0.25? 0.75
平衡浓度(mol/L) 0.75? 0.75? 0.25? 0.75
所以达平衡时,CH4(g)的转化率为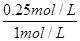 ×100%=25%,A不正确;
×100%=25%,A不正确;
0~10 min 内,v(CO)=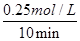 =0.025 mol?L-1·min-1,B不正确;
=0.025 mol?L-1·min-1,B不正确;
该反应的化学平衡常数K=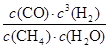 =
=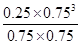 =0.1875 mol2?L-2,C不正确;
=0.1875 mol2?L-2,C不正确;
CH4(g)的消耗速率与H2O(g)的生成速率方向相反,因此当二者相等时,反应达到平衡状态,D正确,答案选D。
考点:考查可逆反应反应速率、转化率和平衡常数的计算以及平衡状态的判断
本题难度:简单
2、选择题 在氯化亚铁溶液中加入下列物质能产生沉淀的是
A.通入硫化氢气体
B.加入氯化钠溶液
C.加入硫化钠溶液
D.通入二氧化碳气体
参考答案:C
本题解析:亚铁离子在碱性条件下易产生沉淀,而A.B.D是酸性或中性,只有C项是碱性。同时硫化亚铁易溶于酸。
本题难度:困难
3、选择题 在下列物质中,分别加入金属钠,不能产生氢气的是
A.无水酒精
B.蒸馏水
C.苯
D.乙酸
参考答案:C
本题解析:分析:根据能跟钠反应的有机物有羧酸、醇、酚、水、酸等.
解答:A、无水酒精能与钠反应,羟基上的氢原子被还原,生成乙醇钠和氢气,故A错误;
B、水与钠反应生成氢氧化钠和氢气,故C错误;
C、苯与钠不反应,故C正确;
D、乙酸能与钠反应,羧基中的氢原子被还原,生成乙酸钠和氢气,故D错误;
故选:C.
点评:本题考查苯、乙醇、乙酸的性质等,难度较小,以识记为主,根据所学知识来解答.
本题难度:一般
4、选择题 实现下列转化,必须加入氧化剂或还原剂的是
A.Cl2→HClO+HCl
B.NH4+→NH3
C.NH3→NO
D.P2O5→H3PO4
参考答案:C
本题解析:试题分析:氯气溶于水即可生成次氯酸和盐酸,该反应中氯气既是氧化剂,也是还原剂;B中不是氧化还原反应;C中氮元素的化合价升高,需要加入氧化剂;D中P元素的化合价不变,不是氧化还原反应,溶于水即可生成磷酸,答案选C。
考点:考查氧化还原反应的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题,试题侧重考查学生分析问题、解决问题的能力。解答该题需要注意的是一些歧化反应,例如选项A。
本题难度:简单
5、填空题 利用化合价推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①SO2的性质________________(填序号,下同)
A.只有氧化性 B.只有还原性 C.既有还原性又有氧化性
②SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应后,锰元素被还原成Mn2+,写出上述反应的离子方程式_________________________________
(2)Fe(OH)2很不稳定,露置在空气中容易被氧化,发生反应的离子方程式为__________________________________________________为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配置的NaOH溶液反应制备。
①用硫酸亚铁晶体配置上述硫酸亚铁溶液时,还需加入_________来防止Fe2+被氧化
②除去蒸馏水中溶解的O2常采用_______的方法
(3)检验Fe3+的方法:_______________________(写出加入试剂的化学式和现象与结论)
参考答案:(1)①C②5SO2+2MnO4-+2H2O=4H++2Mn2++5SO42-(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3①铁粉②加热煮沸(3)取少量溶液置于试管中,滴加几滴KSCN溶液,溶液变红,说明有Fe3+的存在。
本题解析:(1)①SO2中的S化合价是+4价,处于中间价态,既具有还原性又有氧化性,C正确;②SO2具有还原性,酸性KMnO4具有强氧化性,SO2被氧化成SO42-,+7价的Mn被还原成Mn2+,根据反应前后所带电荷数守恒及溶液是酸性,H2O作为反应物,H+作为生成物,因此离子方程式:5SO2+2MnO4-+2H2O=4H++2Mn2++5SO42-;(2)Fe(OH)2容易被氧气氧化成Fe(OH)3,4Fe(OH)2+O2+2H2O=4Fe(OH)3;①因为Fe+2Fe3+=3Fe2+,因此加入少量的铁粉来防止Fe2+被氧化;②溶解在水中的气体,往往采用加热煮沸法处理;(3)检验Fe3+存在,用KSCN溶液进行检验。
考点:考查氧化还原方程式的书写、铁的化合物的性质等相关知识。
本题难度:一般