1、填空题 物质的转化关系如下图所示,其中甲可由两种单质直接化合得到,乙为金属单质,
F的溶液中只含一种溶质,G为酸,乙在G的浓溶液中发生钝化。若用两根玻璃棒分别蘸取A、G的浓溶 液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。则
液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。则
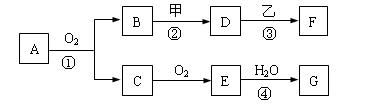
(1)①反应的化学方程式是 ?。
(2)②③两步反应的离子方程式分别是?,
。
(3)在④的反应中,每1molE参加反应,将会有? mol电子发生转移。
参考答案:(1)①反应的化学方程式是4NH3+5O2==4NO+6H2O 。
(2)②③两步反应的离子方程式分别是2Na2O2+2H2O==4Na++4OH-+O2?,
2Al+2OH-+6H2O==2[Al(OH)4]-+3H2?。
(3)在④的反应中,每1molE参加反应,将会有 2/3? mol电子发生转移。
本题解析:略
本题难度:简单
2、推断题 室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下列框图进行反应。又知E溶液是无色的。
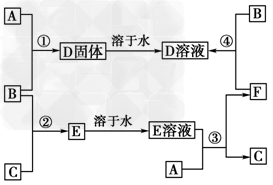
请回答:
(1)试写出下列物质的化学式: A________,B________,C________。
(2)反应①的化学方程式:_____________________________。
(3)反应③的化学方程式:______________________________。
(4)反应④的化学方程式:______________________________。
参考答案:(1)Fe;Cl2;H2
(2)2Fe+3Cl2 2FeCl3
2FeCl3
(3)2HCl+Fe===FeCl2+H2↑
(4)2FeCl2+Cl2===2FeCl3
本题解析:
本题难度:一般
3、简答题 A、B、C、D、E五种物质中含有同一种元素,其相互转化关系如图所示.其中A、B、C、D在常温下都是气体,B为红棕色.
(1)写出各下列物质的化学式:则A是______,D是______;
(2)写出下列反应的化学方程式:B→C______,E→C______.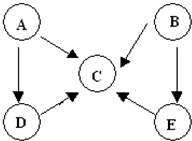
参考答案:B为红棕色,应为NO2,根据NO2的性质可知NO2反应能分别生成NO和HNO3,则C应为NO,E为HNO3,NO2可与水反应生成
NO,稀HNO3可与Cu反应生成NO,含N元素物质中能生成NO的还有N2和NH3,其中N2和氢气反应还可生成NH3,
则分别是:A:N2,B:NO2,C:NO,D:NH3,E:HNO3,
(1)由以上分析可知A为N2,D为NH3,故答案为:N2;NH3;
(2)NO2可与水反应生成NO,方程式为3NO2+H2O=2HNO3+NO,稀HNO3可与Cu反应生成NO,
反应的方程式为8HNO3+3Cu=3Cu(NO3)2+2NO+4H2O,
故答案为:3NO2+H2O=2HNO3+NO;8HNO3+3Cu=3Cu(NO3)2+2NO+4H2O.
本题解析:
本题难度:一般
4、简答题 现有A、B、C、D四种气体,A是密度最小的气体,B在通常情况下呈现黄绿色,把四种气体分别通入酸性硝酸银溶液中,通入B、D气体时立即出现白色沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D.D通入到Na2CO3溶液中产生无色无刺激性气味的C,C通入澄清石灰水时变浑浊.
(1)A、B、C、D的分子式分别为:A______B______C______D______.
(2)写出下列各反应的化学方程式:B与水______.
参考答案:A是密度最小的气体,应为H2,B在通常情况下呈现黄绿色,应为Cl2,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D,应为HCl,D通入到Na2CO3溶液中产生无色无刺激性气味的C,应为CO2,
(1)由以上分析可知,A为H2,B为Cl2,C为CO2,D为HCl,故答案为:H2;Cl2;CO2;HCl;
(2)B为Cl2,与水反应生成HCl和HClO,反应的方程式为Cl2+H2O=HCl+HClO,故答案为:Cl2+H2O=HCl+HClO.
本题解析:
本题难度:一般
5、简答题 甲、乙、丙、丁为四种常见单质,常温下,乙、丙、丁为气体.丙常用于自来水消毒,甲是生活中常见金属,A在通常情况下为无色液体,B、C在溶液中反应.
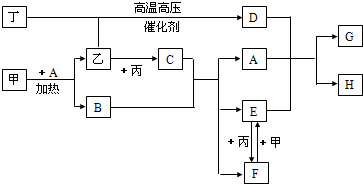
(1)D的化学式为______;闻气体丙的正确方法是______;取少量长期放置的丙的水溶液,滴入几滴石蕊试液,可观察到的现象是______.
(2)甲+A反应的化学方程式为______.
(3)F+甲反应的离子方程式为______;该反应中,证明甲适量或过量的方法是______.
(4)A+D+E反应的离子方程式为______;该反应能顺利进行,是利用了D的______的性质;若反应在试管中进行一,则其现象为______.
参考答案:丙常用于自来水消毒,应为Cl2,A在通常情况下为无色液体,应为H2O,甲是生活中常见金属且能与水在加热条件下反应,则甲为Fe,乙为H2,B为Fe3O4,C为HCl,由转化关系可知E为FeCl2,F为FeCl3,丁与氢气在高温、高压、催化剂作用下反应,应是合成氨的反应,则丁为N2,D为NH3,D、A、E反应生成Fe(OH)2和NH4Cl,
(1)由以上分析可知D为NH3,丙为Cl2,有毒,闻气味时应用手在瓶口轻轻煽动,使极少量气体飘进鼻孔,长期放置氯水,由于HClO分解生成HCl,则滴入几滴石蕊试液,溶液变红,
故答案为:NH3;扇闻;溶液变红;
(2)Fe和水在高温下发生反应生成四氧化三铁和氢气,反应的方程式为3Fe+4H2O?△?.?Fe3O4+4H2,故答案为:3Fe+4H2O?△?.?Fe3O4+4H2;
(3)F+甲为FeCl3和Fe的反应,反应的离子方程式为2Fe3++Fe=3Fe2+,如Fe过量,则溶液中不存在Fe3+,可用KSCN溶液检验,操作方法为取少量反应后的溶液于试管中,滴入几滴KSCN溶液,若溶液不变色,说明甲过量或适量,
故答案为:2Fe3++Fe=3Fe2+;取少量反应后的溶液于试管中,滴入几滴KSCN溶液,若溶液不变色,说明甲过量或适量;
(4)D、A、E反应生成Fe(OH)2和NH4Cl,反应的离子方程式为Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+,氨气极易溶于水,且溶液呈碱性,生成的白色絮状Fe(OH)2沉淀不稳定,易被空气中氧气氧化而迅速变成灰绿色,最后变成红褐色,
故答案为:Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+;极易溶于水且溶于水后显碱性;先生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色.
本题解析:
本题难度:一般