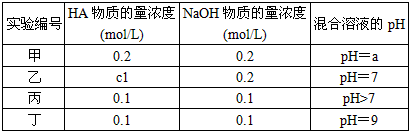
1、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表
请回答下列问题:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA 是强酸还是弱酸
?____________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol/L______? (填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是________。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是______酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是
________________________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=_________mol/L。写出该混合溶液中下列算式的精确结果(不能做近似计算)。 c(Na+)-c(A-)=________mol/L
参考答案:(1)如a=7,HA为强酸,如a>7,则为弱酸
(2)否;C
(3)弱;c(Na+)>c(A-)>c (OH-)>c(H+)
(4)10-5;10-5-10-9
本题解析:
本题难度:一般
2、选择题 关于常温下pH=2的醋酸溶液,下列叙述正确的是
A.c(CH3COOH)=0.01mol·L-1
B.c(H+)=c(CH3COO-)
C.加水稀释100倍后,溶液pH=4
D.加入醋酸钠固体,可抑制醋酸的电离
参考答案:D
本题解析:A、CH3COOH为弱酸,pH=2的醋酸溶液c(H+)=0.01mol?L?1,c(CH3COOH)远远大于0.01mol?L?1,错误;B、因为H2O也能电离出H+,所以c(H+)>c(CH3COO-),错误;C、加水稀释100倍后,CH3COOH电离平衡向右移动,所以pH<4,错误;D、加入醋酸钠固体,CH3COO?浓度增大,CH3COOH的电离平衡向左移动,抑制了醋酸的电离,正确。
本题难度:一般
3、实验题 (9分)某化学兴趣小组在学习了电解质的有关知识后,老师提出了一个“电解质水溶液导电能力的强弱的影响因素”的课题。让该小组来完成课题的研究,已知HCl在水中能完全电离。
(1)该小组同学首先用密度为1.049 g·cm-3的乙酸(CH3COOH)和质量分数为36.5%,密度为1.18 g·cm-3的浓盐酸分别配制1 mol/L CH3COOH溶液和1 mol/L HCl溶液各500 mL,则他们应该量取乙酸和浓盐酸的体积分别为 和 ;
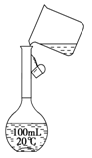
(2)某同学在配制500 mL 1 mol/L的CH3COOH溶液时,向容量瓶中转移溶液时操作如图所示,图中的错误有 ;
(3)他们首先用下图所示装置测1 mol/L的CH3COOH溶液和1 mol/L HCl溶液的导电能力,接通电源后发现与HCl溶液相连的灯泡较亮,有同学认为乙酸是弱电解质,你 (填“同意”或“不同意”)他的观点,通过该现象你得到的结论是

(4)他们又用上述装置测物质的量浓度相同的CuSO4溶液和NaOH溶液的导电能力,接通电源后发现与CuSO4溶液相连的灯泡较亮,有同学认为NaOH是弱电解质,你 (填“同意”或“不同意”)他的观点,通过该现象你得到的结论是 ;
(5)通过上述探究实验,你能得到的结论是
参考答案:(共9分)
(1)28.6 mL(2分) 42.4 mL(2分)
(2)未用玻璃棒引流(1分);未采用500 mL容量瓶(1分)
(3)同意 阴、阳离子带电荷数目相同时,单位体积内自由移动离子数目越大,电解质溶液的导电能力越强(1分)
(4)不同意 当单位体积内自由移动离子数目相同时,阴、阳离子带电荷数目越多,电解质溶液的导电能力越强(1分)
(5)电解质溶液的导电能力是由单位体积内自由移动离子数目和离子所带电荷数目共同决定(1分)
本题解析:本题重点考查了溶液的配制及溶液的导电性的影响因素。
(1)两者均为0.5mol
乙酸:V="0.5×60/1..049=28.6" mL 盐酸:0.5×36.5/(36.5%×1.18)="42.4" mL
其它详见答案
本题难度:一般
4、选择题 4.下列电离方程式中正确的是
A.NaHCO3溶于水:NaHCO3=Na++H++CO32-
B.NaHSO4熔化:NaHSO4=Na++H++SO42-
C.HF溶于少量水中:2HF H++HF2一
H++HF2一
D.(NH4)2 SO4溶于水:(NH4)2 SO4=2NH4++SO42一