1、填空题 根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题。
(1)氧化剂__________,还原剂____________
(2)用双线桥法标明电子转移的方向和数目
8NH3? +? 3Cl2? =? 6NH4Cl? +? N2
参考答案:(4分)Cl2?NH3? (每空1分)
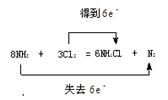 ?(2分)
?(2分)
本题解析:8NH3+3Cl2=6NH4Cl+N2?氧化剂是氯气;还原剂是氨气;
用双线桥法标明电子转移的方向和数目如下:

点评:解答氧化还原反应的问题时依据的规律为:氧化剂得电子,化合价降低,还原剂失电子,化合价升高。
本题难度:一般
2、填空题 (12分)工业上以铬铁矿(主要成分FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O)的主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H 2SO4 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
(1)工业上反应①需不断搅拌,其目的是 。
(2)下图是红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶解度曲线。
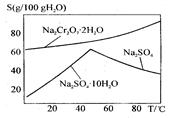
从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7晶体的操作:
先将混合溶液蒸发结晶,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
(3)Na2Cr2O7与KCl进行复分解反应可制取K2Cr2O7,现用重铬酸钾测定铁矿石中铁的含量,测定原理为:Fe2++Cr2O72-+H+ Fe3++ Cr3+ +7H2O (未配平)
Fe3++ Cr3+ +7H2O (未配平)
实验步骤如下:
步骤1:将m g铁矿石加浓盐酸加热溶解 步骤2:加入SnCl2溶液将Fe3+还原
步骤3:将所得溶液冷却,加入HgCl2溶液,将过量的Sn2+氧化为Sn4+
步骤4:加入15 mL硫酸和磷酸的混合酸及5滴0.2%二苯胺磺酸钠指示剂
步骤5:立即用c mol·L-1重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液V mL
①如省去步骤③,则所测定的铁的含量 (填“偏高”、“偏低”或“无影响”)。
②步骤5使用的主要玻璃仪器有 。
③则测定铁矿石中铁的含量的计算式为 (用字母表示,不用化简)。
参考答案:(1)使反应物接触更充分,加快反应速率(2分)
(2)除去析出Na2SO4的晶体,又能防止Na2Cr2O7·2H2O因冷却结晶析出而损失(2分)
冷却结晶(2分)
(3)①偏高(2分);②酸式滴定管 锥形瓶(2分);③56×6VC/1000m。
本题解析:(1)工业上反应①需不断搅拌,其目的是使反应物接触更充分,加快反应速率;(2)根据图像可知红矾钠(Na2Cr2O7·2H2O)和的溶解度随温度的升高而增大,而Na2SO4的溶解度在温度是50℃下温度越高,溶解度越大;当温度超过50℃时,温度越高,溶解度反而越小。所以先将混合溶液蒸发结晶,趁热过滤。趁热过滤的目的是除去析出Na2SO4的晶体,又能防止Na2Cr2O7·2H2O因冷却结晶析出而损失;然后将滤液冷却结晶,而析出红矾钠;(3)①如省去步骤③,则在反应过程中Sn2+氧化也需要消耗氧化剂重铬酸钾,因此会导致Fe的含量偏高;②步骤5是滴定操作,应该使用的仪器有盛装有强氧化性的物质重铬酸钾溶液的酸式滴定管,以及进行物质含量测定的反应容器锥形瓶;③6Fe2++Cr2O72-+14H+ ="=" 6Fe3++ 2Cr3+ +7H2O 。n(重铬酸钾)=" c" mol/L×V mL×10-3L/ml=cv×10-3mol;由于在氧化还原反应中电子守恒,所以n(Fe2+)=6n(Cr2O72-)= 6cv×10-3mol.则测定铁矿石中铁的含量的计算式为[(6cv×10-3mol)×56g/mol]÷m g=56×6VC/1000m。
考点:考查影响化学反应速率的因素、混合物分离的方法、滴定方法在物质含量测定中的应用、误差分析的知识。
本题难度:困难
3、选择题 下列化学用语或叙述正确的是(? )
A.-OH与OH-均是10电子粒子
B.H2O2的电子式:H+[:O: O:]2-H+
C.在分子晶体中不一定有化学键
D.在晶体中,有阳离子就一定有阴离子
参考答案:C
本题解析:略
本题难度:简单
4、选择题 下列变化属于氧化还原反应的是
A.碘的升华
B.次氯酸见光分解
C.氢氧化铁受热分解
D.氧化铜溶于盐酸中
参考答案:B
本题解析:凡是有元素化合价升降的反应都是氧化还原反应,因此选项B是氧化还原反应,其余选项都不是氧化还原反应,答案选B。
点评:凡是有元素化合价升降的反应都是氧化还原反应,因此判断反应是不是氧化还原反应的关键就是准确判断出有关元素的化合价变化情况,所以记住常见元素的化合价非常重要。
本题难度:一般
5、填空题 某探究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案:
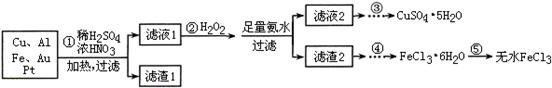
已知:Cu2+ + 4NH3·H2O=[Cu(NH3)4]2+ + 4H2O
请回答下列问题:
(1)步骤①Cu与酸反应的离子方程式为 。
(2)步骤②加H2O2的作用是 ,滤渣2为(填化学式) 。
(3)步骤⑤不能直接加热脱水的理由是 。
(4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH =
(已知:Ksp[Cu(OH)2]=2.0×10-20)。
(5)已知:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点的依据是 。
四次平行实验耗去Na2S2O3标准溶液数据如下:
实验序号
| 1
| 2
| 3
| 4
|
消耗Na2S2O3标准溶液(mL)
| 25.00
| 25.02
| 26.20
| 24.98
|
此产品中CuSO4·5H2O的质量分数为 。
参考答案:(1)Cu + 4H+ + 2NO3? = Cu2+ +2NO2↑+ 2H2O 3Cu+8H++2NO3? 3Cu2++2NO↑+4H2O (任写一个给2分)
3Cu2++2NO↑+4H2O (任写一个给2分)
(2)将Fe2+氧化成Fe3+ (1分) Fe(OH)3、Al(OH)3 (各1分共2分)
(3)FeCl3易水解:FeCl3+3H2O  Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。(2分)
Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。(2分)
(4) 5 (2分)
(5)溶液由蓝色褪为无色且半分钟内不恢复原色 (2分) 83.3% (2分)
本题解析:(1)浓硝酸与稀硫酸混合后,可能为浓硝酸也可能为稀硝酸,所以离子方程式为:Cu + 4H+ + 2NO3? = Cu2+ +2NO2↑+ 2H2O或3Cu+8H++2NO3? 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O
(2)H2O2具有强氧化性,所以H2O2的作用是将Fe2+氧化成Fe3+;加入足量氨水,Fe3+、Al3+转化为Fe(OH)3沉淀和Al(OH)3沉淀,所以滤渣2为Fe(OH)3、Al(OH)3。
(3)FeCl3为强酸弱碱盐,容易发生水解反应:FeCl3+3H2O  Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。
Fe(OH)3+3HCl,加热能促进FeCl3的水解,蒸干得不到FeCl3。
(4)c2(OH?)?c(Cu2+)= Ksp[Cu(OH)2],代入数据可求出c(OH?)=1.0×10-9mol?L?1,pH=-lgc(H+)=-lg【Kw÷c(OH?)】=5。
(5)Cu2+把I?氧化为I2,加入淀粉溶液变蓝,用Na2S2O3标准溶液滴定,达到滴定终点时,Na2S2O3与I2恰好完全反应,所以达到滴定终点的依据是:溶液由蓝色褪为无色且半分钟内不恢复原色;实验3所测数据明显大于其他3组数据,说明实验3出现了实验错误,应舍去,根据其他3组数据求出平均值,根据2Cu2++4I-= 2CuI↓+I2和I2+2S2O32-= 2I-+S4O62-可得对应关系:S2O32- ~ Cu2+,所以n(CuSO4?5H2O)=n(Cu2+)=n(S2O32- )=0.080 mol·L-1 ×(25.00+25.02+24.98)/3L=0.002mol,所以此产品中CuSO4·5H2O的质量分数为:0.002mol×250g/mol×5÷3.00g×100%=83.3%
考点:本题考查化学流程的分析、化学方程式的书写、盐类水解的应用、pH的计算、氧化还原反应滴定及计算。
本题难度:困难