1、填空题 亚硫酸钠中的+4价硫,既有氧化性,又有还原性。现有试剂:溴水、Na2S溶液、 Na2SO3溶液、稀硫酸、NaOH溶液、氨水。
(1)要证明Na2SO3具有还原性,应选用的试剂有_____,看到的现象是___________________________________。
反应的离子方程式为:_______________________。
(2)要证明Na2SO3具有氧化性,应选用的试剂有_____,看到的现象是___________________________________。
反应的离子方程式为:_______________________。
参考答案:(1)溴水、Na2SO3溶液 溴水颜色逐渐褪去? SO32-+Br2+H2O=SO42-+2Br-+2H+
(2)Na2S溶液、Na2SO3溶液、稀硫酸?有淡黄色的沉淀生成? SO32-+2S2-+6H+=3S↓+3H2O
本题解析:要证明Na2SO3具有还原性,只能选择氧化剂溴水,且溴水会褪色;要证明Na2SO3具有氧化性,应选用还原剂Na2S溶液,并选择稀硫酸作为酸性介质。
本题难度:一般
2、选择题 全社会都在倡导诚信,然而总是有一部分不法商贩在背道而驰。如有些商贩为了使银耳增白,就用硫黄(燃烧硫黄)对银耳进行熏制,用这种方法制取的洁白的银耳对人体是有害的。这些不法商贩增白银耳利用的是
[? ]
A.S的漂白性
B.S的还原性
C.SO2的漂白性
D.SO2的还原性
参考答案:C
本题解析:
本题难度:简单
3、实验题 (6分)下图为浓硫酸与铜反应的实验装置图。

(1)浓硫酸与铜反应的化学方程式为??。
(2)实验中,当产生的气体进入盛有品红溶液的仪器b中时,品红溶液将?,原因是?。
参考答案:(6分)Cu + 2H2SO4(浓) ?CuSO4 +SO2 ↑+2H2O,褪色,SO2具有漂白性。
?CuSO4 +SO2 ↑+2H2O,褪色,SO2具有漂白性。
本题解析:浓硫酸具有强氧化性,可将铜氧化为硫酸铜,而部分硫酸被还原为二氧化硫:Cu + 2H2SO4(浓) ?CuSO4 +SO2 ↑+2H2O;
?CuSO4 +SO2 ↑+2H2O;
由于二氧化硫具有漂白性,可与品红结合生成无色化合物,故可使品红试液褪色。
本题难度:一般
4、填空题 (14分)工业生产中含硫废水的排放会污染环境,需要对含硫废水进行处理与利用。
(1)某制革厂含硫废水中主要含有物是Na2S。
①测得该废水溶液pH=12,用离子方程式解释溶液呈碱性的原因?。
②含硫废水的处理过程中可以采用纯氧将Na2S转化为Na2SO4,则反应中还原剂与氧化剂的物质的量之比为?。已知1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g) 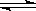 Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
Na2S(s) + 4H2O(g) ,已知该反应的平衡常数K1000℃<K1400℃,则该反应的△H______0(填“>”“=”或“<”)。
(2)含硫燃料中间体废水中主要含有物为Na2SO3,回收废水中的硫化物,以减少资源的浪费,可采用以下方法:

①中和含酸废水工业常用的试剂x是?。
②写出H2S气体与足量NaOH溶液反应的化学方程式?。
③铁屑与石墨能形成微型原电池,SO32—在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32—在酸性条件下放电生成H2S的电极反应式:?。
④已知:2H2S(g)+O2(g) =" 2" S(s) +2 H2O(l)?△H=" —632.8" kJ/mol
SO2 (g)?=" S(s)" + O2(g)?△H= +269.8kJ/mol
H2S与O2反应生成SO2和H2O的热化学方程式为?。
参考答案:(14分)
(1)①S2—+ H2O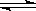 HS— + OH—?(2分)
HS— + OH—?(2分)
② 1:2?(2分)? >?(2分)
(2)①石灰水?(2分)
② H2S + 2NaOH = Na2S + 2H2O?(2分)
③ SO32—+ 8H+ + 6e—= H2S↑+ 3H2O?(2分)
④ 2H2S(g)+3O2(g) = 2SO2 (g) + 2H2O(l)?△H= —1172.4kJ/mol?(2分,合理给分)
本题解析:略
本题难度:一般
5、选择题 接触室里装一个热交换器,其主要目的是()
A.冷却反应后的混合气体,使SO3凝华后析出
B.给催化剂加热
C.把反应放出的热量传递给需要预热的反应混合气体
D.降低接触室的温度,以免温度过高烧坏设备
参考答案:C
本题解析:接触室里装一个热交换器只是为了在冷却产物气体的同时预热原料气体,从而提高能量的利用率,以降低成本,提高效益。
本题难度:简单