1、选择题 向含有FeCl3和BaCl2的溶液中通入过量的SO2气体,发现有白色沉淀生成,且溶液变浅绿色。下列判断正确的是(?)
A 加入KSCN溶液将变红
B 向溶液中加入NaOH溶液,将立即生成红棕色沉淀
C 向溶液中加入硝酸,沉淀将不溶解
D 白色沉淀是亚硫酸钡
参考答案:C
本题解析:略
本题难度:简单
2、选择题 将SO2通入BaCl?2溶液至饱和,未见有沉淀,继续通入另一种气体X仍无沉淀,则X可能是:
A.CO2
B.NH3
C.NO2
D.H2S
参考答案:A
本题解析:A、SO2与CO2都不与BaCl2反应,并且所对应的酸都比盐酸弱,通入SO2与CO2都不会生成沉淀,故A选;B、Cl2具有氧化性,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,故B不选;C、通入NH3溶液呈碱性,溶液中生成大量的SO32-离子,生成沉淀BaSO3,故C不选;D、NO2与水反应生成具有氧化性的硝酸,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,故D不选;
本题难度:一般
3、填空题 假设116号元素存在,完成下列问题:?
(1)116号元素在元素周期表中的位置是___________________________________。?
(2)下列关于116号元素的说法中正确的是_________________。?
A.无氧酸钠盐的化学式为Na2R的形式?
B.最高价氧化物可能是碱性氧化物?
C.原子的近似相对原子质量必定为332?
参考答案:(1)第七周期、ⅥA族 (2)B
本题解析:已知元素的原子序数判断元素在周期表中的位置,方法之一是参照ⅠA族和0族元素原子序数法。元素周期表第七周期的ⅠA族元素原子序数为87,0族元素原子序数为118,87<116<118。故116号元素在周期表的第七周期、倒数第三个族——ⅥA族。
周期表第ⅥA族第五周期的元素碲虽然为非金属元素,但有一定的金属性,如单质碲为银白色、能导电。根据周期表同主族内元素性质变化的规律判断可知,116号元素是金属元素,且其金属性较强或很强。金属元素的最高价氧化物可能是碱性氧化物,但它不存在无氧酸,自然就没有Na2R这种形式的盐。
原子的近似相对原子质量就是原子的质量数。元素原子序数是116,该元素中可能有同位素,或者说该元素可能包括两种或更多种不同的核素。在现有条件下,不能确定该元素中任何一种核素原子核内的中子数,也就不能确定原子的近似相对原子质量。
本题难度:简单
4、选择题 在①硫酸②重晶石③三氧化硫④绿矾四种化合物中,硫元素的质量分数由高到底排列的顺序是()
A.①>②>③>④
B.②>③>④>①
C.①>③>②>④
D.③>①>②>④
参考答案:D
本题解析:根据化学式H2SO4、BaSO4、SO3、FeSO4·H2O,分子中都含有1个S原子,所以物质的相对分子质量越大,S元素的含量越低,即应该是③>①>②>④,答案选D。
点评:该题在进行计算时,应该充分利用物质的组成特点,即都含有1个S原子,然后通过比较相对分子质量即可,这样省去了计算的繁琐。
本题难度:一般
5、选择题 将90%H2SO4溶液和10%H2SO4溶液等体积混合,所得溶液的百分比浓度为( )
A.小于50%
B.大于50%
C.等于50%
D.不能确定
参考答案:B
本题解析:设各取体积为 L,90%H2SO4密度为
L,90%H2SO4密度为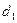 ,10%H2SO4密度为
,10%H2SO4密度为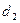 ,则
,则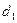 >
>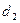 。依题意,混合后溶液的百分比浓度
。依题意,混合后溶液的百分比浓度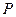 %=
%=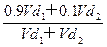 =
=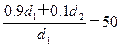 %=
%=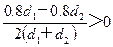
所以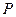 %>50%,选B。
%>50%,选B。
本题难度:简单