1、填空题 某小组用铜屑制取硫酸铜溶液。将铜屑放入一定浓度的硫酸中,加热并不断鼓入空气其反应原理为2Cu+O2+2H2SO4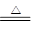 2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算:
2CuSO4+2H2O。现欲将6.4 g铜完全溶解,加水后得200 mL溶液。计算:
(1)参加反应的氧气在标准状况下的体积是 。
(2)所得硫酸铜溶液的物质的量浓度是 。
(3)取100 mL上述硫酸铜溶液,加水稀释至0.1 mol/L,稀释后硫酸铜溶液的体积是 。
参考答案:(1)1.12 L (2)0.5 mol/L (3)500 mL
本题解析:(1)由方程式2Cu+O2+2H2SO4 2CuSO4+2H2O可知:n(Cu)=2n(O2). n(Cu)=6.4g÷64g/mol=0.1mol,所以n(O2)="1/2" n(Cu)=0.05mol,V(O2)= 0.05mol×22.4L/mol=1.12L.(2)n(CuSO4)= n(Cu)=0.1mol.C(CuSO4)="n/V=0.1mol÷0.2L=0.5" mol/L。(3)在溶液稀释前后溶质的物质的量不变。0.5 mol/L×0.1L="0.1" mol/LV,所以V="0.5" L="500" mL。
2CuSO4+2H2O可知:n(Cu)=2n(O2). n(Cu)=6.4g÷64g/mol=0.1mol,所以n(O2)="1/2" n(Cu)=0.05mol,V(O2)= 0.05mol×22.4L/mol=1.12L.(2)n(CuSO4)= n(Cu)=0.1mol.C(CuSO4)="n/V=0.1mol÷0.2L=0.5" mol/L。(3)在溶液稀释前后溶质的物质的量不变。0.5 mol/L×0.1L="0.1" mol/LV,所以V="0.5" L="500" mL。
考点:考查物质的量在气体的体积、物质的量浓度的溶液的计算及溶液稀释等计算的应用。
本题难度:一般
2、选择题 下列溶液中Cl-浓度最大的是( )
A.10ml 0.2mol/L的FeCl3溶液
B.10ml 0.1mol/L的AlCl3溶液
C.20ml 0.1mol/L的MgCl2溶液
D.20ml 0.1mol/L的HCl溶液
参考答案:A
本题解析:溶液中不水解的离子的物质的量浓度=溶质的物质的量浓度×化学式中离子的个数,与溶液的体积无关,10mL 0.1mol·L-1的FeCl3溶液中氯离子的物质的量浓度=0.2mol·L-1×3="0.6" mol·L-1,10ml 0.1mol/L的AlCl3溶液中氯离子的物质的量浓度=0.1mol·L-1×3="0.3" mol·L-1,20ml 0.1mol/L的MgCl2溶液中氯离子的物质的量浓度=0.1mol·L-1×2="0.2" mol·L-1,20ml 0.1mol/L的HCl溶液中氯离子的物质的量浓度=0.1mol·L-1×1=0.1mol·L-1,所以选A。
本题难度:一般
3、简答题 用18mol/L浓硫酸配制100ml3.0mol/L稀硫酸的实验有以下步骤:
①计算所用浓硫酸的体积②稀释③量取一定体积的浓硫酸④定容、摇匀⑤转移、洗涤
回答下列问题
(1)上述步骤的正确顺序是______;
(2)本实验用到的玻璃仪器有______;
(3)本实验所需浓硫酸的体积是______ml,
量取浓硫酸所用的量筒的规格是______.(用序号表示)(从下列中选用A.10mlB.25mlC.50mlD.100ml)
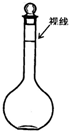
(4)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?(填“偏高”、“偏低”、“无影响”)______;
若没有进行操作步骤⑤,会______(填“偏高”、“偏低”、“无影响”);
(5)若加蒸馏水时不慎超过了刻度线,应如何操作?______.
参考答案:(1)根据计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作步骤排序,所以其操作顺序为:①③②⑤④,
故答案为:①③②⑤④;
(2)用100mL容量瓶配制溶液,用量筒量取浓硫酸,用烧杯稀释浓硫酸,用玻璃棒搅拌和引流,用胶头滴管定容,
故答案为:100mL容量瓶、量筒、烧杯、玻璃棒、胶头滴管;
(3)设浓硫酸的体积为V,18mol/L×V=3.0mol/L×0.1L,V=0.0167L=16.7mL,选取的量筒规格应该等于或稍微大于浓硫酸的体积,所以选取25mL量筒,故答案为:16.7;B;
(4)某同学观察液面的情况如图所示,溶液的体积偏小,配制溶液浓度偏高;
若没有进行操作步骤⑤,溶质的物质的量偏小,配制溶液浓度偏低;
故答案为:偏高;偏低;
(5)若加蒸馏水时不慎超过了刻度线,应重新配制,故答案为:重新配制.
本题解析:
本题难度:一般
4、填空题 CO2的摩尔质量是 ;2molCO2的质量是 ;它在标准状况下所占的体积约为 ,所含的分子数目约为 ;所含氧原子的数目约为 。
参考答案:44 g/mol, 88g 44.8L 1.204×1024 2.408×1024
本题解析:如果用g/mol为单位,则物质的摩尔质量在数值等于物质的相对分子质量或相对原子质量,所以CO2的摩尔质量是44g/mol;根据n=m/M可知,2molCO2的质量是88g;根据V=n·Vm可知,标准状况下的体积是44.8L;根据N=n·NA可知,所含的分子数目约为1.204×1024;所含氧原子的数目约为1.204×1024×2=2.408×1024。
本题难度:一般
5、选择题 欲配制100mL1.0mol?L-1Na2SO4溶液,正确的方法是( )
①将14.2gNa2SO4溶于100mL水中
②将32.2gNa2SO4?10H2O溶于少量水中,再用水稀释至100mL
③将20mL5.0mol?L-1Na2SO4溶液用水稀释至100mL.
A.①②
B.②③
C.①③
D.①②③
参考答案:①14.2gNa2SO4的物质的量为14.2g142g/mol=0.1mol,溶液的体积不等于溶剂的体积,所以无法计算出物质的量浓度,故①错误;
②32.2gNa2SO4?10H2O物质的量为32.2g322g/mol=0.1mol,硫酸钠的物质的量等于硫酸钠晶体的物质的量,硫酸钠的物质的量浓度c=0.1mol0.1L=1.0mol?L-1,故②正确;
③根据稀释定律,稀释前后溶质硫酸钠的物质的量不变,则20ml×5mol/L=100ml×c(硫酸钠),则c(硫酸钠)=1mol/L,故③正确.
故选:B;
本题解析:
本题难度:一般