1、选择题 体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:
2SO2+O2 2SO3,并达到平衡。在这过程中,甲容器保持压强不变,乙容器保持体积不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持压强不变,乙容器保持体积不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率
[? ]
A.等于P%
B.小于P%
C.大于P%
D.无法判断
参考答案:C
本题解析:
本题难度:一般
2、选择题 某温度下,在一容积可变的恒压密闭容器里,反应3A(g)?B(g)+3C(g)达到平衡时,A、B和C的物质的量分别为6mol、2mol、6mol.在保持温度和压强不变的条件下,下列说法正确的是( )
A.充入1?mol氦(He)(He与容器中气体不反应),平衡将向正反应方向移动
B.充入A、B、C各2?mol,平衡将向正反应方向移动
C.将A、B、C各减少1?mol,C的百分含量增加
D.加入一定量的A气体达平衡后,C的百分含量一定增加
参考答案:A、He不参加反应,压强不变,应使容器体积增大,参加反应的物质的浓度减小,平衡向正反应方向移动,故A正确;
B、从等效平衡的角度思考,如加入A、B、C分别为2mol、23mol、2mol,则平衡不移动,现充入A、B、C各2mol,相当于在加入A、B、C分别为2mol、23mol、2mol的基础上加入13molB,则平衡向逆反应方向移动,故B错误;
C、将A、B、C各物质的量都减少1mol,若减少A、B、C分别为1mol、13mol、1mol,平衡不移动,现将A、B、C各物质的量都减少1mol,相当于减少B23mol,平衡正向进行,C的百分含量增大,故C正确;
D、恒温恒压容器中,加入A相当于增大压强,平衡向气体体积减少的方向移动,即平衡向逆向进行,C的百分含量减少;故D错误;
故选AC.
本题解析:
本题难度:简单
3、填空题 研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1) NO2可用水吸收,相应的化学反应方程式为__________________,
利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_____________L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是_____________L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6kJ·mol-1
2SO3(g) △H=-196.6kJ·mol-1
2NO(g)+O2(g) = 2NO2(g) △H=-113.0 kJ·mol-1
则反应SO2(g)+NO2(g) = SO3(g)+ NO(g)的△H=________ kJ·mol-1 一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO2和NO的体积比保持不变
D.每消耗1molSO3的同时生成1mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如右图所示。该反应△H___0(填“>”或“<”)实际生产条件控制在250℃、1.3ⅹ104 kPa左右,选择此压强的理由是_______。
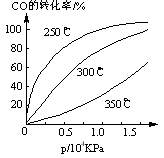
参考答案:(1)3NO2+H2O = 2HNO3+NO;6.72
(2)-41.8;B;2.67或8/3
(3)<;在1.3×104Kpa下,CO转化率已较高,再增大压强CO转化率提高不大,而生产成本增加,故得不偿失。
本题解析:
本题难度:一般
4、选择题 X、Y、Z是三种气态物质,在一定温度下其变化符合下图。下列说法一定正确的是
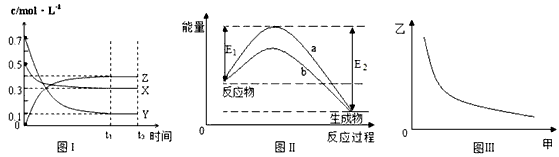
[? ]
A.该反应热化学方程式为X(g) +3Y(g)  ?2Z(g) △H= -(E2-E1)
?2Z(g) △H= -(E2-E1)
B.若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线
C.若升高温度,该反应的平衡常数减小,Y的转化率降低
D.图II中曲线b是加入催化剂时的能量变化曲线,曲线a一定是没有加入催化剂时的能量变化曲线
参考答案:C
本题解析:
本题难度:一般
5、填空题 一密闭容器中发生下列反应:N2(g)+3H2(g)  2NH3(g)(正反应为放热反应),如下图所示是某一时间段中反应速率与反应进程的曲线关系。回答下列问题:
2NH3(g)(正反应为放热反应),如下图所示是某一时间段中反应速率与反应进程的曲线关系。回答下列问题:

(1)处于平衡状态的时间段是________。
(2)t1、t3、t4时刻,体系中分别是什么条件?t1______,t3_______,t4______。
(3)下列时间段中,氨的体积分数最高的是___________。
A.t2~t3
B.t3~t4
C.t4~t5
D.t5~t6
参考答案:(1)t0~ t1,t2~t3,t3 ~t4,t5~t6
(2)增大反应物浓度 ;使用催化剂 ;降低反应温度
(3)D
本题解析:
本题难度:一般