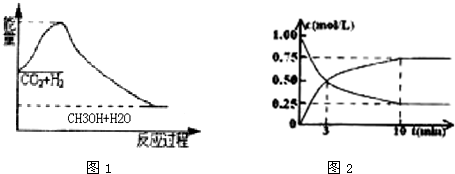
1、简答题 2009年12月7日~18日在丹麦首都哥本哈根召开了世界气候大会,商讨《京都议定书》一期承诺到期后的后续方案,即2012年至2020年的全球减排协议,大会倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ?mol-1)的变化:
(1)关于该反应的下列说法中,正确的是______(填字母).
A.△H>0,△S>0
B.△H>0,△S<0
C.△H<0,△S<O
D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在1L固定体积的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),经测得CO2和CH3OH(g)的浓度随时间变化如图2所示.
①从反应开始到平衡,CO2的平均反应速率v(CO2)=______.
②该反应的平衡常数表达式K=______.
③下列措施中能使化学平衡向正反应方向移动的是______.(填字母)
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入1molCO2和3molH2
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出362.9kJ的热量,写出该反应的热化学方程式为______.
参考答案:(1)依据反应和图象分析判断:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),气体的物质的量减少,反应是熵减少的反应△S<0;反应物能量高于生成物的能量,判断反应是放热反应,△H<0,
故答案为:C;
(2)二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L,则:
①v(CO2)=0.75mol/L10min=0.075mol/(L?min);
故答案为:0.075mol/(L?min);
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的平衡常数表达式K=c(H2O)c(CH3OH)c(CO2)c3(H2),
故答案为:c(H2O)c(CH3OH)c(CO2)c3(H2);
③措施中能使化学平衡向正反应方向移动的是:
A、反应是放热反应,升温平衡逆向进行;故A错误;
B、将CH3OH(g)及时液化抽出,减小生成物的量,平衡正向进行,故B正确;
C、选择高效催化剂只能改变速率,不改变化学平衡,故C错误;
D、再充入l molCO2和4molH2,增大压强平衡正向进行,故D正确;
故选:BD;
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出362.9kJ的热量,则1mol甲醇完全燃烧恢复到原状态时,放出热量
=362.9kJ×1mol×32g/mol16g=725.8kJ,故甲醇燃烧热的热化学方程式为:CH3OH(l)+32O2(g)=CO2(g)+2H2O(l)△H=-725.8 kJ?mol-1;
故答案为:CH3OH(l)+32O2(g)=CO2(g)+2H2O(l)△H=-725.8 kJ?mol-1.
本题解析:
本题难度:一般
2、选择题 密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g) ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图
2Z(g) ΔH<0。该反应的速率(v)随时间(t)变化的关系如下图
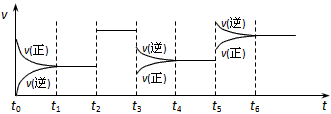
t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是
[? ]
A.t4~t5时间内转化率一定最低
B.t3时降低了温度
C.t5时增大了压强
D.t2时加入了催化剂
参考答案:D
本题解析:
本题难度:一般
3、选择题 HClO是比H2CO3更弱的酸,反应:Cl2+H2O?HCl+HClO达到平衡后,要使HClO浓度增加,可以加入( )
A.NaOH
B.HCl
C.CaCO3(固)
D.H2O
参考答案:A.NaOH和HCl、HCOl都反应,不能使HClO浓度增加,故A错误;
B.加入HCl,溶液氢离子浓度增大,平衡向逆反应方向移动,HClO浓度减小,故B错误;
C.加入碳酸钙固体,HCl与碳酸钙反应,而HClO不反应,溶液中氢离子浓度减小,平衡向正反应方向移动,HClO浓度增加,故C正确;
D.加入水,溶液体积增大,虽然平衡向正反应方向移动,但溶液浓度反而降低,故D错误.
故选C.
本题解析:
本题难度:一般
4、选择题 低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g) 2N2(g)+ 3H2O(g) △H<0,在恒容的密闭容器中,下列有关说法正确的是
2N2(g)+ 3H2O(g) △H<0,在恒容的密闭容器中,下列有关说法正确的是
[? ]
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
参考答案:C
本题解析:
本题难度:一般
5、填空题 混合物平均摩尔质量通常可表示为: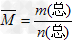 ,利用此概念可以讨论许多化学问题:
,利用此概念可以讨论许多化学问题:
(1)相同条件下,潮湿空气的密度________(选填“>”、“<”或“=”)干燥空气的密度。
(2)在一定条件下的恒容密闭容器中,建立如下平衡:5O2(g)+4NH3(g) 4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡_______?(填“正向移动”、“逆向移动”、“不移动”),?(混合气)将?______(填写“变大”、“变小”或“不变”);
4NO(g)+6H2O(g);假如温度保持不变并充入He,则平衡_______?(填“正向移动”、“逆向移动”、“不移动”),?(混合气)将?______(填写“变大”、“变小”或“不变”);
(3)在一定温度下恒容密闭容器中,当下列物理量不再变化时,不能表明反应:A(s)+2B(g) C(g)+D(g)已达平衡的是____________?
C(g)+D(g)已达平衡的是____________?
A.混合气体的平均相对分子质量
B.混合气体的密度
C.B的物质的量浓度 ?
D.气体的总物质的量
参考答案:(1)<?
(2)不移动;变小?
(3)D
本题解析:
本题难度:一般