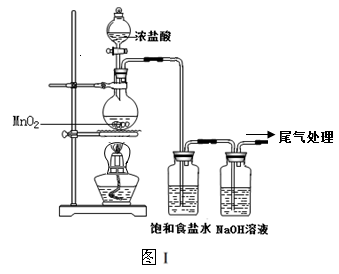
1、实验题 某校兴趣小组用如图Ⅰ装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。
 ?
?
实验操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯。
(1)烧瓶中反应的化学方程式是?。
(2)饱和食盐水的作用是?。
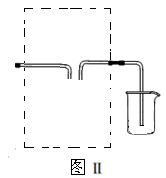
(3)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低。
查阅资料:在溶液中发生反应:
(a)Cl2(g)+2NaOH(aq)═ NaCl(aq)+NaClO(aq)+H2O(l)?H1=-101.1kJ/mol
(b)3NaClO(aq)═2NaCl(aq)+NaClO3(aq)?H2=-112.2kJ/mol
反应(a)的反应速率很快,反应(b)在室温下较慢
根据资料,请对图Ⅰ装置提出改进建议:?。
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液。他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。
提出猜想:ⅰ.NaClO把Na2SO3氧化了
ⅱ.NaClO把酚酞氧化了
ⅲ.NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是?。
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是?。
参考答案:(1)MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O(2)除去氯气中的氯化氢
MnCl2+Cl2↑+2H2O(2)除去氯气中的氯化氢
(3) (4)将盛NaOH溶液的洗气瓶浸在冰水中?(5)①b d ②向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;若溶液变红说明酚酞没有被氧化。
(4)将盛NaOH溶液的洗气瓶浸在冰水中?(5)①b d ②向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;若溶液变红说明酚酞没有被氧化。
本题解析:(1)烧瓶中反应的化学方程式是MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,注意:①要写有加热符号;②必须为浓盐酸。(2)饱和食盐水的作用是除去氯气中混有的氯化氢气体;饱和氯化钠溶液可以降低氯气的溶解度;饱和氯化钠溶液可吸收氯化氢气体。(4)温度降低可以促进次氯酸钠的生成,所以我们可以将装置浸泡在冰水里。(5)只要能检验出硫酸根离子的存在,就可以证明NaClO氧化了Na2SO3。检验硫酸根离子办法:向混合后的溶液中加入过量盐酸,再加入氯化钡溶液,如果产生白色沉淀就能证明硫酸根离子的存在;向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸,如果还能生成白色沉淀就证明硫酸根离子的存在。②为证明NaClO氧化了酚酞,只要向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;若溶液变红说明酚酞没有被氧化。
MnCl2+Cl2↑+2H2O,注意:①要写有加热符号;②必须为浓盐酸。(2)饱和食盐水的作用是除去氯气中混有的氯化氢气体;饱和氯化钠溶液可以降低氯气的溶解度;饱和氯化钠溶液可吸收氯化氢气体。(4)温度降低可以促进次氯酸钠的生成,所以我们可以将装置浸泡在冰水里。(5)只要能检验出硫酸根离子的存在,就可以证明NaClO氧化了Na2SO3。检验硫酸根离子办法:向混合后的溶液中加入过量盐酸,再加入氯化钡溶液,如果产生白色沉淀就能证明硫酸根离子的存在;向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸,如果还能生成白色沉淀就证明硫酸根离子的存在。②为证明NaClO氧化了酚酞,只要向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;若溶液变红说明酚酞没有被氧化。
本题难度:困难
2、实验题 实验室用MnO2和浓盐酸制取氯气并验证氯气的部分性质,实验装置如下图所示。
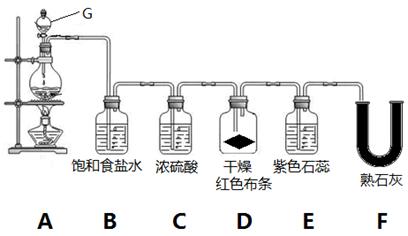
(1)G装置名称___________________。A装置的离子反应化学方程式是?,氧化剂与还原剂的物质的量之比为?。
(2)B装置的作用是_____________。
(3)实验开始几分钟后,D装置红布条是否褪色__________,E装置中观察到的现象是_____________
_____________________________________________________________。
(4)装置F中发生反应的化学方程式是_____________________________________________________。(5)F装置后应再连接一个尾气处理装置,装置里加入NaOH溶液,尾气处理的离子反应方程式为_____
____________________________________________________。
参考答案:(1)分液漏斗(1分)?MnO2+4H++2Cl- Mn2++Cl2↑+2H2O(2分)?1:2?(1分)
Mn2++Cl2↑+2H2O(2分)?1:2?(1分)
(2)除氯气中的氯化氢(1分)?(3) 不褪色,?(1分)?先变红后褪色?(1分)
(4)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O?(2分) (5)Cl2+2OH-=Cl-+ClO-+H2O?(2分)
本题解析:(1)根据装置的特点可知,G装置是分液漏斗;A装置是制备氯气的,反应的离子反应方程式是MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。其中二氧化锰中Mn元素的化合价从+4价降低到+2价,得到2个电子,二氧化锰是氧化剂。氯化氢中氯元素的化合价从-1价升高到0价,失去1个电子,氯化氢是还原剂。根据电子得失守恒可知,氧化剂与还原剂的物质的量之比是1:2。
Mn2++Cl2↑+2H2O。其中二氧化锰中Mn元素的化合价从+4价降低到+2价,得到2个电子,二氧化锰是氧化剂。氯化氢中氯元素的化合价从-1价升高到0价,失去1个电子,氯化氢是还原剂。根据电子得失守恒可知,氧化剂与还原剂的物质的量之比是1:2。
(2)由于浓盐酸易挥发,生成的氯气中含有氯化氢,所以B装置的作用是除氯气中的氯化氢。
(3)由于生成的氯气先经过浓硫酸被干燥,干燥的氯气不能使有色布条褪色,所以实验开始几分钟后,D装置红布条不褪色。氯气溶于水生成盐酸和次氯酸,溶液具有酸性和强氧化性,所以E装置中观察到的现象是先变红后褪色。
(4)氯气是酸性气体,与熟石灰反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
(5)氯气有毒需要尾气处理,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
本题难度:一般
3、填空题 (12分)A~G各物质间的关系如下图,其中B、D为气态单质。
MnO2①Fe点燃
MnO2②△
请回答下列问题:
(1)物质C和E的名称分别为________、________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式___________;
若只能在加热情况下进行,则反应物A应为________;
(3)反应②的化学方程式为_____________________;
(4)新配制的F溶液应加入________以防止其转化为G。检验G溶液中阳离子的常用试剂
是________,实验现象为_____________________________。
参考答案:(9分)(1) __浓盐酸_、_四氧化三铁__;
(2) _2H2O22H2O+O2↑_;?_ KClO3_;
(3) 4HCl(浓)+MnO2MnCl2+2H2O+Cl2↑;(2分)
(4) _铁粉__ _ KSCN(或NH4SCN)溶_, __溶液变红_
本题解析:略
本题难度:一般
4、实验题 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸(H2C2O4)在60时反应制得。某学生拟有左下图所示的装置模拟制取并收集ClO2。

(1)A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式:?。
(2)A必须添加温度控制装置,除酒精灯外,还需要的玻璃仪器有烧杯、?;B也必须添加温度控制装置,应该是?(选填“冰水浴”或“热水浴”)装置。
(3)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2的操作步骤:
①?;②?;③洗涤;④干燥。
(4)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是?。
ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100.00 mL试样;量取V1 mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol·L—1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知2 Na2S2O3 + I2 →Na2S4O6 + 2NaI)
(5)判断滴定终点的现象?。原ClO2溶液的浓度为?g / L(用步骤中的字母代数式表示)。
参考答案:(1)2KClO3+ H2C2O4  ?K2CO3+CO2↑+2ClO2↑+H2O ?(2分)
?K2CO3+CO2↑+2ClO2↑+H2O ?(2分)
(2)温度计 冰水浴 (2分)
(3)蒸发结晶 趁热过滤 (2分)
(4)根据氧化还原反应过程中电子转移守恒,反应整个过程中氯元素最终为-1价,所以FeSO4所失去的电子数相等,消耗的FeSO4的量也相等。 (2分)
(5)加到最后一滴时,溶液的颜色突然由蓝色变为无色,且半分钟不变化(2分) 135cV2/V1(2分)
本题解析:(1)A中反应产物有K2CO3、ClO2和CO2等,加热60℃,氯酸钾和草酸反应生成碳酸钾、二氧化碳、二氧化氯和水,反应方程式为:2KClO3+H2C2O4=K2CO3+CO2↑+2ClO2↑+H2O;
(2)要控制温度必须使用温度计测量温度,在60℃时反应制得,应用水浴加热,可用烧杯(或水浴锅),二氧化氯的熔点较低,为收集二氧化氯,应在较低温度下进行,所以应该采用冰水浴,故答案为:冰水浴;?烧杯(或水浴锅),温度计;
(3)根据信息NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2的溶解度曲线,随着温度升高溶解度增大,因此请补充从NaClO2溶液中制得NaClO2的操作步骤为蒸发结晶和趁热过滤。
(4)根据氧化还原反应过程中电子转移守恒,反应整个过程中氯元素最终为-1价,所以FeSO4所失去的电子数相等,消耗的FeSO4的量也相等。
(5)判断滴定终点的现象为滴定终点时,I2完全反应,溶液由蓝色变为无色,故答案为:蓝色变为无色且半分钟不变化;
(6)设原ClO2溶液的浓度为x,
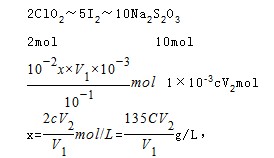
本题难度:一般
5、选择题 下列关于Cl2和SO2的说法正确的是( )
A.两者漂白原理相同
B.两者都可用水吸收,减少污染
C.两者都能与碱发生氧化还原反应
D.两者都是有毒气体
参考答案:A.二氧化硫的漂白性是利用二氧化硫和有色物质反应生成无色物质,氯气的漂白原理是:氯气和水反应生成次氯酸,次氯酸具有漂白性,是利用次氯酸的强氧化性进行漂白,所以二者漂白原理不同,故A错误;
B.二氧化硫和氯气都有毒,1体积水溶解2体积氯气,1体积水溶解40体积二氧化硫,氯气在水中的溶解度较小,所以不能用水吸收,应该用碱液吸收而减少污染,故B错误;
C.二氧化硫和碱反应生成亚硫酸盐,反应中各元素化合价都不变,所以不是氧化还原反应,故C错误;
D.氯气和二氧化硫都是有毒气体,所以不能直接排空,应该用碱液吸收,故D正确;
故选D.
本题解析:
本题难度:一般