1、选择题 饱和氯水长时间放置后,下列微粒在溶液中的物质的量增加的是
A.Cl—
B.HClO
C.Cl2
D.ClO—
参考答案:A
本题解析:Cl2+H2O  ?HCl+HClO,HClO见光分解,导致平衡右移,且HClO
?HCl+HClO,HClO见光分解,导致平衡右移,且HClO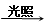 HCl,所以Cl—浓度增大。
HCl,所以Cl—浓度增大。
本题难度:一般
2、填空题 已知氯水中有如下平衡: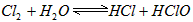 常温下,在一个体积为50mL的针筒里吸入40mL氯气后,再吸进10mL水。写出针筒中可能观察到的现象_____________________。可将此针筒长时间放置,又可能看到何种变化_____________________试用平衡观点加以解释_____________________。
常温下,在一个体积为50mL的针筒里吸入40mL氯气后,再吸进10mL水。写出针筒中可能观察到的现象_____________________。可将此针筒长时间放置,又可能看到何种变化_____________________试用平衡观点加以解释_____________________。
参考答案:气体体积缩小,溶液呈浅黄绿色;气体体积进一步缩小,气体和溶液均变为无色;氯水中的平衡:
Cl2+H2O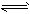 HCl+HClO,由于HClO逐渐分解而使平衡不断地向右移动,最终了Cl2耗尽,导致气体体积缩小和黄绿色消褪。
HCl+HClO,由于HClO逐渐分解而使平衡不断地向右移动,最终了Cl2耗尽,导致气体体积缩小和黄绿色消褪。
本题解析:
本题难度:一般
3、简答题 下列说法正确的是( )
①世博会中国馆一一“东方之冠”使用的钢筋混凝土属于高分子化合物;
②CH3COONa、BaSO4一都是强电解质;
③明矾和氯气可用于饮用水的净化和杀菌消毒,且两者的作用原理不同;
④0.1mol/L?NaOH溶液与0.1mol/L?Ba(OH)2溶液的pH相同;
⑤一定温度下,适量CO2分别通入饱和碳酸钠溶液和澄清石灰水中,都会出现浑浊.
A.①③④
B.①②④
C.②③⑤
D.③④⑤
参考答案:①钢筋混凝土是指通过在混凝土中加入钢筋与之共同工作来改善混凝土力学性质的一种组合材料,故①错误;
②CH3COONa、BaSO4熔融时能完全电离,所以都是强电解质,故②正确;
③明矾中含有Al3+,水解呈酸性,生成Al(OH)3,Al(OH)3能吸附水中悬浮的杂质;氯气有强氧化性,能杀菌消毒,故③正确;
④0.1mol?L-1NaoH溶液中氢氧根离子的物质的量浓度是0.2mol/L,0.1mol?L-1Ba(OH)2溶液中氢氧根离子的物质的量浓度是0.4mol/L,所以两种溶液的pH不相同,故④错误;
⑤二氧化碳和碳酸钠反应生成碳酸氢钠,碳酸氢钠的溶解性大于碳酸钠的溶解性,所以向饱和的碳酸钠溶液中通入适量的二氧化碳,会出现浑浊;适量的二氧化碳和氢氧化钙反应生成难溶性的碳酸钙,所以会出现浑浊,故⑤正确.
故选C.
本题解析:
本题难度:一般
4、选择题 下列实验现象描述正确的是
[? ]
A.碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色
B.红热的铜丝在氯气中燃烧,产生了棕黄色的烟雾
C.电解氯化钠饱和溶液,将阴极气体产物通入碘化钾淀粉溶液中,溶液变蓝
D.溴化钠溶液中加入少量新制的氯水振荡,再加入少量四氯化碳振荡,静置后上层 颜色变浅,下层颜色变为橙红色
参考答案:D
本题解析:
本题难度:一般
5、填空题 如图所示,是一个制取氯气并以氯气为原料进行特定反应的装置,其中各试剂瓶装的试剂为:B(氢硫酸)、C(溴化亚铁溶液)、D(碘化钾淀粉溶液)、E(混有SO2的氯化钡溶液)、F(水)、H(紫色石蕊试液)。

(1)A是氯气发生装置,其离子反应方程式是:__________。
(2)Ⅰ中b瓶内加入的液体最好是____________。
(3)用图示的Ⅱ或Ⅲ代替Ⅰ是否可行?________,简要说明理由_____________________________。
(4)实验开始时,先点燃A处酒精灯,打开分液漏斗旋塞和Ⅰ处活塞,让氯气充满整个装置,再点燃G处酒精灯,回答下列问题:
①怎样证明氯气已充满整个装置?_____________。
②下列装置中的现象是C______________________;
D________;E____________;F________________。
(5)G装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,其产物为二氧化碳和氯化氢,写出G中反应的化学方程式_______________________。装置F的作用是______________________。
(6)在H处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是______________________________。
参考答案:(1)MnO2+4H++2Cl-(浓)△Mn2++Cl2↑+2H2O
(2)饱和食盐水
(3)Ⅱ可行,Ⅲ不可行 Ⅱ原理同Ⅰ,而Ⅲ中因c瓶口密封,体积不能改变,压强增大会有危险
(4)①观察,当整个装置内充满黄绿色气体时,说明氯气已充满整个装置
②溶液由浅绿色变为深红棕色 溶液变蓝 生成白色沉淀 溶液变为浅黄绿色
(5)C+2H2O+2Cl2△CO2+4HCl 向G中提供反应所需的水蒸气
(6)生成HCl使紫色石蕊试液变红色,剩余的氯气又与水反应生成HClO,起漂白作用,使红色褪去
本题解析:(2)b瓶的作用是贮存多余的Cl2,试剂最好为饱和食盐水。
(3)Ⅱ原理同Ⅰ,可代替Ⅰ;Ⅲ中c瓶口密封,不安全。
(4)①当黄绿色气体充满整个装置时,说明Cl2充满。
②Cl2有强氧化性,可将Fe2+、Br-、I-、SO2氧化为Fe3+、Br2、I2、SO,故C中溶液由浅绿色变为深红棕色;D中溶液变蓝;E中产生白色沉淀BaSO4;F中由于吸收了Cl2变为浅黄绿色。
(5)C+2H2O+2Cl2△CO2+4HCl,F的作用是提供水蒸气。
(6)生成HCl使溶液变红,剩余Cl2与水反应生成HClO又起漂白作用。
本题难度:简单