1、填空题 (15分)
(一)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。下表为几种弱酸在25℃时的电离平衡常数
回答下列问题:
(1)K只与温度有关,当温度升高时,K值____(填“增大”、“减小”、“不变”)。
(2)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是_________,最弱的是________。
(3)对于同一种多元弱酸,有不止一个电离平衡常数,多个常数K1、K2、K3、之间存在某种大小关系,此关系是________________;以碳酸为例,用离子方程式和必要的文字说明产生此规律的原因_________________________。
(4)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的 的电离转化率为____,则该温度下醋酸的电离平衡常数
的电离转化率为____,则该温度下醋酸的电离平衡常数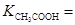 _____。
_____。
(二)化合物SOCl2是一种液态化合物,沸点77 ℃。在盛有10 mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色。
(1)写出SOCl2和水反应的化学方程式:_____________________________。
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是 ;用SOCl2与AlCl3·6H2O混合共热得到无水AlCl3,原因是________________________ 。
参考答案:(一)(1)增大 (2)H2PO4-,HPO42-
(3)K1>K2>K3(1分),多元弱酸分步电离,上一级电离产生的H+抑制下一级的电离,所以碳酸的二级电离常数小于一级电离常数:H2CO3 H+ + HCO3-,HCO3-
H+ + HCO3-,HCO3- H+ + CO32-
H+ + CO32-
(4)
(二)(1)SOCl2+H2O = SO2↑+2HCl
(2)Al2O3
因为当与SOCl2混合共热时,由于SOCl2极易吸水,防止AlCl3的水解,同时产生的HCl也可以抑制AlCl3的水解。
本题解析:(1)弱电解质的电离是吸热反应,升高温度促进弱电解质电离,则生成物浓度增大反应物浓度减小,所以K值增大,故答案为:增大;
(2)电离平衡常数越大的酸性越强,越小的酸性越弱,根据表格知,酸性增强的是H2PO4-,最弱的是 HPO42-,故答案为:H2PO4-;HPO42-;
(3)多元弱酸分步电离,第一步电离程度最大,第二步、第三步依次减小,原因是上一级电离产生的H+对下一级电离有抑制作用,以碳酸为例,碳酸的二级电离常数小于一级电离常数:H2CO3 H+ + HCO3-,HCO3-
H+ + HCO3-,HCO3- H+ + CO32-。
H+ + CO32-。
(4)醋酸溶液中水电离出的氢离子浓度很小,对于醋酸电离出的氢离子来说水电离出的氢离子可以忽略,所以该溶液中c(CH3COO-)=c(H+)="c" αmol/L,溶液中c(CH3COOH)=c(1-α)mol/L,
则电离平衡常数K= =
= ,故答案为:
,故答案为: 。
。
(二)(1)依据反应现象分析生成物为有刺激性气味的二氧化硫和氯化氢气体;SOCl2与水反应生成的氯化氢会对氯化铝水解起到抑制作用;反应的化学方程式为:SOCl2+H2O=2HCl↑+SO2↑;
(2)蒸干AlCl3溶液不能得到无水AlCl3,因为蒸干AlCl3溶液时,由于AlCl3水解生成的HCl易挥发,而得到Al(OH)3,继续灼烧会产生Al2O3,若使SOCl2与AlCl3?6H20混合并加热,可得到无水AlCl3,SOCl2与水反应生成的氯化氢会对氯化铝水解起到抑制作用;
故答案为:SOCl2+H2O=2HCl↑+SO2↑;反应产生的氯化氢气体会抑制铝离子的水解;
考点:考查水解平衡及弱电解质的电离平衡和电离度。
本题难度:困难
2、填空题 (11分)(1)常温下,0.10 mol·L-1 NH4Cl溶液pH______7(填“>”、“=”或“<”)。
(2)相同物质的量浓度的Na2CO3溶液与NaHCO3溶液,pH大小:Na2CO3________NaHCO3(填“>”、“=”或“<”)。
(3)在配制FeCl3溶液时,应加入__________,目的是_____________。
(4)Na2S溶液中滴入酚酞溶液显______色,原因是__________________。(用离子方程式表示),
(5)将氯化铝溶液蒸干并灼烧得到的固体物质是 ;(填化学式,下同)将硫酸铝溶液蒸干得到的固体物质是 。
参考答案:(1)<; (2)>;(3) 盐酸,抑制FeCl3水解;(4)红,S2-+H2O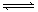 HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O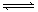 H2S+OH-;(5)Al2O3,Al2(SO4)3。
H2S+OH-;(5)Al2O3,Al2(SO4)3。
本题解析:(1) NH4+水解生成NH3?H2O和H+,溶液呈酸性,则pH<7;(2)两溶液水解呈碱性,Na2CO3以第一步水解为主,Na2CO3的水解程度大于NaHCO3,所以Na2CO3的PH大于NaHCO3;(3) FeCl3水解产生Fe(OH)3和HCl,在配制FeCl3溶液时,应加入盐酸,抑制FeCl3水解;(4)硫化钠水解,S2-+H2O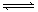 HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O H2S+OH-,溶液显碱性,滴入酚酞试液,溶液呈红色;(5)加热促进氯化铝水解,且氯化氢有挥发性,导致蒸干时得到氢氧化铝固体,再将固体灼烧,氢氧化铝分解生成氧化铝和水,则最后得到的固体是氧化铝;加热促进硫酸铝水解,但硫酸没有挥发性,所以蒸干时得到的固体是硫酸铝。
H2S+OH-,溶液显碱性,滴入酚酞试液,溶液呈红色;(5)加热促进氯化铝水解,且氯化氢有挥发性,导致蒸干时得到氢氧化铝固体,再将固体灼烧,氢氧化铝分解生成氧化铝和水,则最后得到的固体是氧化铝;加热促进硫酸铝水解,但硫酸没有挥发性,所以蒸干时得到的固体是硫酸铝。
考点:考查盐类水解及溶液中离子浓度大小关系比较。
本题难度:一般
3、填空题 (8分)最近雾霾天气又开始肆虐我国大部分地区。其中SO2是造成空气污染的主要原因,利用钠碱循环法可除去SO2。
(1)钠碱循环法中,吸收液为Na2SO3溶液,该吸收反应的离子方程式是
(2)已知H2SO3的电离常数为 K1=1.54×10-2 , K2=1.02×10-7, H2CO3的电离常数为 K1=4.30×10-7, K2= 5.60×10-11,则下列微粒可以共存的是_____________。
A.CO32- HSO3- B.HCO3- HSO3-
C.SO32- HCO3- D.H2SO3 HCO3-
(3)吸收液吸收SO2的过程中,pH随n(SO3²
参考答案:
本题解析:
本题难度:困难
4、选择题 经测定某种溶液中只含NH4+、Cl-、H+、OH-四种离子,下列说法错误的是
A.溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
B.若满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶质一定是NH4Cl和NH3·H2O
C.若满足:c(Cl-)=c(NH4+)>c(OH-)=c(H+),则溶质只有NH4Cl
D.若满足:c(NH4+)=c(Cl-),则溶液一定呈中性
参考答案:C
本题解析:
本题难度:一般
5、选择题 在一定条件下发生下列反应,其中属于盐类水解反应的是( ? )
A.NH4++2H2O?NH3?H2O+H3O+
B.HCO3-+H2O?H3O++CO32-
C.HS-+H+═H2S
D.Cl2+H2O?H++Cl-+HClO
参考答案:A
本题解析:
本题难度:简单