1、选择题 下列各组物质中属于同素异形体的是( )
A.金刚石和C60
B.CH4与CH3CH3
C.
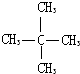
与?

D.
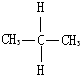
与
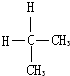
参考答案:A
本题解析:
本题难度:一般
2、选择题 下列关于元素周期律的叙述正确的是
A.随着元素原子序数的递增,原子最外层电子总是从1到8重复出现
B.随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现
C.随着元素原子序数的递增,原子半径从小到大(稀有气体除外)发生周期性变化
D.元素性质的周期性变化是指原子核外电子排布、原子半径及元素主要化合价的周期性变化
参考答案:D
本题解析:
本题难度:简单
3、推断题 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。
请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为_____________。
(2)B的氢化物的分子空间构型是_____________。其中心原子采取_____________杂化。
(3)写出化合物AC2的电子式_____________;一种由B、C组成的化合物与AC2互为等电子体,其化学式为_____________。
(4)E的核外电子排布式是_____________,ECl3形成的配合物的化学式为_____________,
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是__________________________。
参考答案:(1)C<O<N
(2)三角锥形;sp3
(3)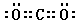 ;N2O
;N2O
(4)1s22s22p63s23p63d54s1(或[Ar]3d54s1);[Cr(NH3)4(H2O)2]Cl3
(5)10HNO3+4Mg==4Mg(NO3)2+NH4NO3+3H2O
本题解析:
本题难度:一般
4、选择题 1993年8月国际原子量委员会确认我国张青莲教授测定的锑原子量(127.760)为标准原子量,已知锑有两种以上天然同位素,则127.760是( )
A.按照锑的各种天然同位素的质量数与这些同位素所占的原子百分比计算出来的平均值
B.按照锑的各种天然同位素的相对原子质量与这些同位素所占的原子百分比计算出来的平均值
C.一个锑原子的质量与12C原子的质量的
的比值
D.锑元素的质量与12C原子质量的的比值
参考答案:B
本题解析:
本题难度:简单
5、选择题 下列说法正确的是?
A.1.00mol NaCl中含有6.02×1023个NaCl分子
B.SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO42-+2HI+2H+
C.加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3-
D.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显