1、选择题 下列各组物质性质的比较正确的是
[? ]
A.酸性:H3PO4>H4SiO4>H2CO3
B.稳定性:H2O>H2S>HF
C.离子半径:S2->Cl->K+
D.离子的氧化性:Na+>Mg2+>Al3+
参考答案:C
本题解析:
本题难度:一般
2、填空题
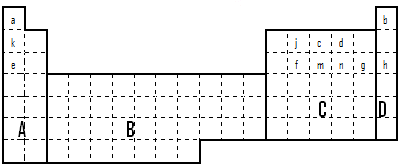
(1)在上面元素周期表中全部是金属元素的区域为______.
(a)A?(b)B?(c)C?(d)D
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或浓硝酸中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等.
用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置.
(3)表中所列小写字母分别代表一种化学元素:①f、m、n、g所形成的氢化物的稳定性还原性由强到弱的顺序为______(填化学式);
②甲、乙、c、d、e形成的简单离子的半径由小到大的顺序为______.(离子用实际离子符号表示)
③f的最高价氧化物制备对应的水化物的化学方程式______
④c元素的单质用途______(填一条).
参考答案:(1)在周期表中,所有的过渡元素均是金属元素,金属元素位于该图中的B区域,故答案为:b;
(2)室温下,属于短周期的甲元素单质在冷的浓硫酸或浓硝酸中,表面都生成致密的氧化膜,只有金属铝符合要求,所以甲是Al,在第三周期第ⅢA族,原子核外M电子层与K电子层上的电子数相等的元素是Mg,在第三周期,第ⅡA族,故答案为:
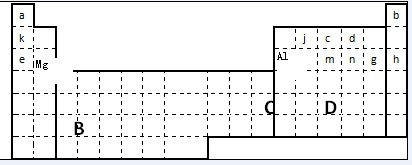
(3)①据元素周期表的结构和元素的分布,可知f、m、n、g分别是:Si、P、S、Cl,同周期元素从左到右,氢化物的稳定性逐渐增强,即HCl>H2S>PH3>SiH4;
②根据元素周期表的结构和元素的分布,可知甲、乙、c、d、e形成的简单离子分别为:Al3+、Mg2+、N3-、O2-、Na+,它们核外电子数相同,则核内质子数越多半径越小,即离子的半径由小到大的顺序为:Al3+、Mg2+、Na+、O2-、N3-,
故答案为:Al3+、Mg2+、Na+、O2-、N3-;
③因二氧化硅不能与水反应,因此二氧化硅先与碱反应生成硅酸钠,然后硅酸钠再与酸反应制得硅酸,故答案为:SiO2+2NaOH=Na2SiO3+H2O;Na2SiO3+2HCl═2NaCl+H2SiO3↓;
④氮气是一种重要的工业原料,化学性质稳定,可做保护气,故答案为:氮气是一种重要的工业原料,化学性质稳定,可做保护气.
本题解析:
本题难度:一般
3、选择题 X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是
[? ]
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列物质中,属于同位素的是( )
A.O2、O3
B.H2、D2
C.23592U、23892U
D.H2O、D2O
参考答案:C
本题解析:
本题难度:简单
5、填空题 在第三周期元素的单质及其化合物中,原子半径最小的元素是______;氧化性最强的单质是_____;还原性最强的单质是______;最高价氧化物对应的水化物中,酸性最强的是______;碱性最强的是_____;形成的两性氢氧化物是______。(用元素符号或化学式表示)
参考答案:Cl;Cl2;Na,HClO4;NaOH;Al(OH)3
本题解析:
本题难度:一般