1、填空题 铜是重要的金属材料。
(1)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为________。电解粗铜制取精铜,电解时,阳极材料是________,电解液中必须含有的阳离子是________。
(2)在100 mL 18 mol·L-1浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4为________mol。
(3)电子工业曾用质量分数为30%的FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得到FeCl3溶液,设计如下实验流程。

上述流程中,所加试剂的化学式为:X________,Y________,Z________;第⑥步反应的离子方程式为
___________________________________________________。
参考答案:(1)O2 粗铜 Cu2+
(2)小于0.9
(3)Fe HCl Cl2 2Fe2++Cl2=2Fe3++2Cl-
本题解析:用30%的FeCl3溶液腐蚀有铜箔的绝缘板印刷电路板时发生反应:2Fe3++Cu=2Fe2++Cu2+,废液中会含有Fe2+、Cu2+、Fe3+;加入铁粉后,2Fe3++Fe=3Fe2+、Fe+Cu2+=Cu+Fe2+;滤渣中含有过量的Fe和Cu,加入盐酸:Fe+2HCl=FeCl2+H2↑;通入Cl2后,2FeCl2+Cl2=2FeCl3。
本题难度:一般
2、选择题 下列各组物质不能按所示关系实现转化的是表示反应一步完成( )
A.

B.
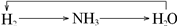
C.
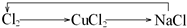
D.

参考答案:D
本题解析:
本题难度:一般
3、选择题 向CuO和Fe的混合物中加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,再向滤液中插入一枚铁钉,发现铁钉无任何变化。根据上述现象判断下列结论正确的是
A.不溶物一定是Cu
B.不溶物中一定含有铜,但不一定含有铁
C.不溶物一定是Fe
D.溶液中一定含有Fe2+,但不一定含有Cu2+
参考答案:B
本题解析:
本题学生应明确离子氧化性大小:Cu2+> H+理解氧化还原反应的先后顺序。
溶液中加入硫酸,产生H+发生反应:CuO + 2H+ = Cu2+ + H2O
Fe + 2H+ = Fe2+ + H2O
但由于氧化性大小:Cu2+> H+可得一个总的过程:
CuO + Fe + 2H+ =" Cu" + H2O + Fe2+
直到CuO反应完以后可看作只发生: Fe + 2H+ = Fe2+ + H2O
由于题中说:可知一定有铜固体;而硫酸是一定量的,加入铁钉无任何变化。所以溶液无铜离子,硫酸也无剩余。
本题难度:简单
4、实验题 Fe2+和I-是两种常见的还原性离子。
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为?;向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式:?。
(2)请以FeSO4溶液、KI溶液、氯水为试剂验证I-的还原性强于Fe2+。设计实验方案,补充完成实验步骤、预期现象和结论。其他限选试剂:3 mol·L-1 H2SO4、0.01 mol·L-1 KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液。
实验步骤
| 预期现象与结论
|
步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加1~2滴氯水。
| ?
?;
|
步骤2:____________________________________
____________________________________。
| ?
|
?
(3)利用(2)提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:取少量样品溶于水, ?。
参考答案:(1)2Fe2++Cl2=2Fe3++Cl-(3分) 2I-+Cl2=I2+2Cl-?(3分)
(2)(6分,各2分)
实验步骤
步骤1:…………………………………………
预期现象与结论
溶液变成黄色
步骤2:向试管中继续滴加几滴20%KSCN溶液
或:向试管中继续滴加几滴淀粉溶液
溶液不变血红色,证明I-的还原性强于Fe2+
或:溶液变蓝色,证明I-的还原性强于Fe2+
?
(3)滴加几滴20%KSCN溶液,无明显现象;再加入过量3%H2O2,溶液变血红色。(4分)
本题解析:(1)硫酸亚铁中滴加强化性的氯水,亚铁离子被氧化为铁离子,所以发生溶液变色,所以离子方程式为2Fe2++Cl2=2Fe3++Cl-?;而往碘化钾溶液中同样滴加氯水,还原性的I-被氧化成碘单质,形成棕黄色的碘水溶液,所以离子方程式为2I-+Cl2=I2+2Cl-。
(2)本探究实验的目的是以FeSO4溶液、KI溶液、氯水为试剂验证I-的还原性强于Fe2+ 。要证明I-的还原性强于Fe2+ ,则可以设计让I-和Fe2+ 混合,然后滴加少量的强氧化剂,根据氧化还原规律,还原性强的先被氧化,所以滴加氯水试剂,只要证明先反应生成碘单质,而没有铁离子生成,即可得到结论。所以具体实验情况如下表:
实验步骤
步骤1:…………………………………………
预期现象与结论
溶液变成黄色
步骤2:向试管中继续滴加几滴20%KSCN溶液
或:向试管中继续滴加几滴淀粉溶液
溶液不变血红色,证明I-的还原性强于Fe2+
或:溶液变蓝色,证明I-的还原性强于Fe2+
?
(3)要证明碘与铁的化合物中铁显+2价,实质上就是利用(2)中提供的20%KSCN试剂来检验亚铁离子,所以正确的操作是:取少量样品溶于水,滴加几滴20%KSCN溶液,无明显现象;再加入过量3%H2O2,溶液变血红色,说明碘与铁的化合物中铁显+2价。
本题难度:一般
5、选择题 在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量浓度之比为:4:2:1,现加入适量的铁粉,使溶液中的三种离子的物质的量浓度之比为:1:3:9,则投入的铁粉与原溶液中Cu2+的物质的量之比为(?)

A.5:4
B.4:5
C.3:5
D.5:6
参考答案:D



本题解析: 溶液中还存在Fe3+,说明溶液中Cu2+没有反应,加入的铁全部反应,将粒子比例调整为:12:6:3和2:6:18,若溶液中由6molCu2+,就有10molFe3+发生反应,消耗5mol铁。
溶液中还存在Fe3+,说明溶液中Cu2+没有反应,加入的铁全部反应,将粒子比例调整为:12:6:3和2:6:18,若溶液中由6molCu2+,就有10molFe3+发生反应,消耗5mol铁。
本题难度:一般