1、计算题 (6分)现有一种铜和铁的混合物样品。为测定该样品中铁的含量,某学生取10.0 g此样品置于烧瓶中,将80.0 mL稀硫酸分四次加入烧瓶并做相关记录。
有关数据记录如下表:
加硫酸的序号
| 加入硫酸的体积/mL
| 剩余固体的质量/g
|
1
| 20.0
| 7.20
|
2
| 20.0
| 4.40
|
3
| 20.0
| 2.00
|
4
| 20.0
| 2.00
|
试计算:
(1)此样品中铁的质量分数。
(2)所用硫酸溶液溶质的物质的量浓度。
2、选择题 把铁粉放入氯化铜和氯化铁的混合溶液中,充分反应后,铁粉全部溶解。由此可判断下列说法正确的是
A.若无铜析出,溶液中有Cu2+、Fe2+和Fe3+离子
B.若无铜析出,溶液中有Cu2+和Fe2+离子,也可能有Fe3+离子
C.若有铜析出,溶液中有Fe2+离子,没有Cu2+和Fe3+离子
D.若有铜析出,溶液中有Fe2+离子,可能有Cu2+离子,也可能有Fe3+离子
3、选择题 下列物质能将Fe3+转化为Fe2+的有(?)
①新制氯水?②铁?③铜?④稀硫酸
A.①②③
B.③④
C.②③
D.①②③④
4、填空题 把2.0 mol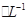 CuSO4和1.0 mol
CuSO4和1.0 mol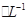 H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:?
H2SO4溶液等体积混合(假设混合后的溶液的体积等于混合前两种溶液的体积之和)计算:?
(1)混合溶液中CuSO4和H2SO4的物质的量浓度
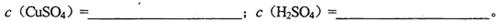
(2)混合液中和的物质的量浓度

(3)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余。此时溶液中的物质的量浓度。c(Fe2+)=_______________________。
5、选择题 在由Fe、FeO和Fe2O3组成的混合物中加入100mL 2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(S.P.T),此时溶液中无Fe3+。则下列判断正确的是?(?)

A.混合物中三种物质反应时消耗盐酸的物质的量之比为1:1:3

B.反应后所得溶液中的Fe2+和Cl–的物质的量之比为1:3

C.混合物中,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多

D.混合物中,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多