1、选择题 海水的进水钢闸门易被腐蚀,对此的下列说法不正确的是
[? ]
A.钢闸门腐蚀的本质是Fe-2e-=Fe2+
B.钢闸门腐蚀主要是发生电化学吸氧腐蚀,其阴极反应是O2+2H2O+4e-=4OH-
C.将钢闸门与浸入海水的锌块用导线相连,可防止钢闸门腐蚀
D.将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀
参考答案:D
本题解析:
本题难度:简单
2、填空题 X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:① X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。?
请回答:
(1)Z2Y的化学式是?。?
(2)Z2Y2与X2Y反应的化学方程式是?。
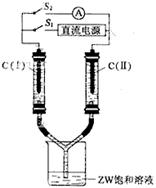
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。?一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(I)的电极名称是?(填写正极或负极);
C(II)的电极反应式是??。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是?。
参考答案:(1)Na2O? (2)2Na2O2+2H2O=4NaOH+O2↑ (3)负极,Cl2+2e-=2Cl-?(4)Cu + H2O2 + 2H+= Cu2++2H2O
本题解析:中学阶段A2B2型的化合物主要指Na2O2和 H2O2,共价化合物是H2O2,离子化合物是Na2O2,所以根据X、Y、Z、W的原子序数大小顺序课判断X是H,Y是O,Z是Na,W是Cl。
(1)Z2Y的化学式是Na2O。?
(2)Z2Y2与X2Y反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑。
(3)根据装置图可知,接通S1后该装置是电解池,即相当于是惰性电极电解饱和氯化钠溶液。C(Ⅰ)附近溶液变红,说明该电极是阴极,生成的气体是氢气,另外一电极生成的是氯气。断开S1,接通S2,电流表的指针发生偏转,说明此时形成原电池,其中氢气所在的电极是负极,即C(I)的电极名称是负极。C(II)的电极是正极,氯气得到电子,电极反应式是Cl2+2e-=2Cl- 。
(4)双氧水具有氧化性,钠氧化单质铜,则反应的离子方程式是Cu + H2O2 + 2H+= Cu2++2H2O。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练,主要是考查学生对常见化合物以及电化学原理的熟悉了解程度,有利于调动学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是记住常见的化合物,明确原电池和电解池的工作原理,然后结合题意灵活运用即可。
本题难度:一般
3、填空题 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁
年产量的1/4。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式。
正极:?;负极:?。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用下图所示甲的方案,其中焊接在铁闸门的固体材料R可以采用?。(请写出具体金属名称)
(3)下图中乙方案也可降低铁闸门腐蚀速率,其中铁闸门应该连接在直流电源
的?极。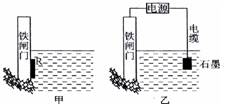
参考答案:(1)正极:O2+2H2O+4e-=4OH—;负极:Fe-2e-=Fe2+。(2) 锌 (3)负
本题解析:略
本题难度:简单
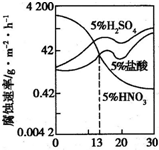
4、选择题 图是一稀酸对Fe-Gr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是( )
A.稀硝酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:Fe+6HNO3(稀)═Fe(NO3)3+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强
D.随着Cr含量增加,稀硫酸对Fe-Cr合金的腐蚀性减弱