1、选择题 下列说法正确的是( )
A.反应中化合价降低的物质是还原剂
B.有氧元素参加的反应一定是氧化还原反应
C.反应前后元素化合价没有变化的反应一定不是氧化还原反应
D.氧化剂在反应中被氧化,还原剂在反应中被还原
参考答案:A.含元素化合价降低的物质为氧化剂,含元素化合价升高的物质为还原剂,故A错误;
B.有氧元素参加不一定有化合价的变化,如氧化钙与水的反应,故B错误;
C.氧化还原反应的特征为化合价的升降,则元素化合价没有变化,不属于氧化还原反应,故C正确;
D.氧化剂在反应中得到电子被还原,还原剂在反应中失去电子被氧化,故D错误;
故选C.
本题解析:
本题难度:一般
2、选择题 2007年3月22日是第十五届“世界水日”.我国纪念“世界水日”和开展“中国水周”活动的宣传主题“水利发展与和谐社会”.下列有关水的化学反应中,水既不是氧化剂也不是还原剂的氧化还原反应是( )
A.2Na+2H2O=2NaOH+H2↑
B.3NO2+H2O=2HNO3+NO
C.SO2+H2O=H2SO3
D.Cl2+H2O=HCl+HClO
参考答案:BD
本题解析:
本题难度:简单
3、选择题 已知:5FeS2+14CuSO4+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
A.氧化产物是Cu2S
B.每5摩尔FeS2参与反应,转移电子21摩尔
C.被还原的元素只有铜元素
D.FeSO4中的SO42-一定都是氧化产物
参考答案:分析反应?
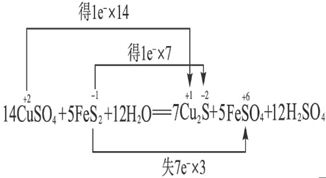
? 可知,
A、CuSO4中Cu的化合价降低生成Cu2S,FeS2中S的化合价也降低生成Cu2S,故被还原的元素有Cu和S,Cu2S只是还原产物,非氧化产物,故A错误;
B、由反应可知5molFeS2发生反应,有3mol×7=21 mol电子转移,故B正确;
C、由分析可知,Cu、S元素的化合价降低,则被还原的元素有有Cu和S,故C错误;
D、产物中SO42- 有一部分是氧化产物,另一部分由CuSO4提供,故D错误;
故选B.
本题解析:
本题难度:一般
4、简答题 已知:6.4克铜与适量的浓硝酸反应,当铜完全溶解后,共收集到NO和NO2混合气体共2.24升(已折算为标准状况).求:(1)被还原的HNO3的物质的量;(2)参加反应的HNO3的物质的量.
参考答案:(1)因HNO3中+5价的N被还原成NO中的+2价和NO2中的+4价,说明HNO3中的N得到了电子,Cu是被氧化的,失去了电子,这个过程中,得失电子守恒,即HNO3中N得到的电子=Cu失去的电子.
产生的还原产物NO和NO2总共2.24L(标况),所以产生的NO和NO2总的物质的量是2.24/22.4=0.1mol,无论HNO3和Cu反应生成NO也好,NO2也好,
总之,发生氧化还原反应的N元素是守恒的,HNO3→NO,HNO3→NO2,是一一对应的(只看N元素守恒),
所以参加氧化还原反应的HNO3的物质的量,就等于生成的NO和NO2的物质的量的和为0.1mol.
答:被还原的HNO3的物质的量为0.1mol.
(2)我们从整体上分析,看HNO3中的N元素的走向,无非是 HNO3--NO、NO2 和Cu(NO3)2(只看N元素),那么硝酸的物质的量,就应该等于NO、NO2 和Cu(NO3)2中N元素的物质的量.NO+NO2物质的量已经知道了,就是0.1mol,那么求出Cu(NO3)2的物质的量就OK了.
?而Cu→Cu(NO3)2,也就是说,有多少摩尔的Cu就会产生多少摩尔的Cu(NO3)2,Cu的质量为6.4g,完全溶解的,所以消耗Cu的物质的量为6.4g64g/mol=0.1mol,所以Cu(NO3)2的物质的量为0.1mol,所以HNO3用来产生Cu(NO3)2而需要的物质的量为2倍的Cu的物质的量,故为0.1mol×2=0.2mol.
反应的HNO3的物质的量为0.1+0.2=0.3mol.
答:参加反应的HNO3的物质的量为0.3mol.
本题解析:
本题难度:一般
5、填空题 水在很多的反应中,起到极其重要的作用.根据下面水参与的反应,回答问题:
①2F2+2H2O═4HF+O2 ②2Na2O2+2H2O═4NaOH+O2↑
③2Na+2H2O═2NaOH+H2↑?④2H2O
2H2↑+O2↑
(1)水只作氧化剂的是______;(填写序号,下同)水只作还原剂的是______;水既作氧化剂,又做还原剂的是______;水既不是氧化剂,又不是还原剂的氧化还原反应是______.
(2)请标出下列反应的电子转移的方向和数目.
3Cl2+6NaOH=5NaCl+NaClO3+3H2O
(3)上述反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O若转移5mol电子,则所得氧化产物的物质的量为______mol.
参考答案:(1)①该反应中,水中O元素失电子化合价升高,所以水中还原剂;
②该反应中水中的H和O元素的化合价都不变,所以水既不是氧化剂又不是还原剂;
③该反应中钠失电子化合价升高,水中氢元素得电子化合价降低,所以水作氧化剂;?
④该反应中,水中的H元素得电子化合价降低,水中的O元素失电子化合价升高,所以水既是氧化剂又是还原剂;
故答案为:③;①;④;②;
(2)反应3Cl2+6NaOH(热,浓)═5NaCl+NaClO3+H2O中,化合价升高的元素是Cl,化合价降低的元素也是氯元素,化合价升高数目=化合价降低数目=转移电子数目=5,电子转移的方向和数目如下所示:
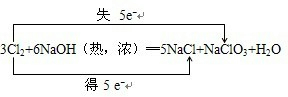
,
故答案为:

;
(3)该反应中的氧化产物是氯酸钠,氯酸钠和转移电子之间的关系式是1:5,所以若转移5mol电子,则所得氧化产物的物质的量为1mol,故答案为:1.
本题解析:
本题难度:一般