1、选择题 实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl═NaCl+N2↑+2H2O关于该反应的下列说法不正确的是( )
A.NH4Cl氮元素被还原
B.每生成1?mol?N2时,转移电子的物质的量为3?mol
C.被氧化的氮原子与被还原的氮原子之比为1:1
D.N2既是氧化产物,又是还原产物
参考答案:由NaNO2+NH4Cl═NaCl+N2↑+2H2O可知,NaNO2中N元素的化合价由+3价降低为0,NH4Cl中N元素的化合价由-3价升高为0,
A.NH4Cl中N元素的化合价升高,则N元素被氧化,故A错误;
B.由化合价变化可知,每生成1?molN2时,转移电子的物质的量为(3-0)mol=3mol,故B正确;
C.由电子守恒可知,被氧化的氮原子与被还原的氮原子之比为1:1,故C正确;
D.该反应中只有N元素的化合价变化,则生成物中的N2既是氧化产物,又是还原产物,故D正确;
故选A.
本题解析:
本题难度:简单
2、选择题 下列变化中,必须加入氧化剂的是( )
A.CuO→CuSO4
B.CO2→CO
C.H2O2→O2
D.S2-→S
参考答案:A.该反应中,铜和氧元素的化合价都不变,所以不发生氧化还原反应,故A错误;
B.二氧化碳生成一氧化碳,碳元素的化合价降低,则二氧化碳作氧化剂,必须加入还原剂才能实现,如碳,故B错误;
C.H2O2→O2,双氧水分解生成水和氧气,双氧水既是氧化剂又是还原剂,故C错误;
D.S2-→S,硫元素的化合价升高,应加入氧化剂才能实现,故D正确;
故选D.
本题解析:
本题难度:一般
3、填空题 用双线桥法标出下列氧化还原反应中电子转移的方向和数目,并指出氧化剂和氧化产物
(1)标出电子转移情况:MnO2+4HCl(浓)=MnCl2+2H2O+Cl2↑(2)氧化剂是______,氧化产物是______.(填化学式)
参考答案:(1)化合价升高的Cl元素失2mol电子,化合价降低的Mn元素得到2mol电子,电子转移情况为:
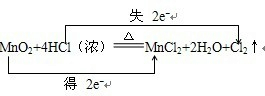
,故答案为:

;
(2)化合价升高元素是Cl,所在反应物HCl是还原剂,对应产物Cl2是氧化产物,化合价降低的是Mn元素得,所在反应物MnO2是氧化剂,故答案为:MnO2;Cl2.
本题解析:
本题难度:一般
4、选择题 治理汽车尾气的方法之一是在汽车排气管上装一个“催化转换器”.发生的化学反应为:2CO+2NO=N2+2CO2,其中的氧化剂是( )
A.CO
B.NO
C.N2
D.CO2
参考答案:B
本题解析:
解析:化学2CO+2NO=N2+2CO2中,NO中氮元素的化合价降低,被还原,具有氧化性,为氧化剂;CO中碳元素的化合价升高,具有还原性,被氧化,生成物中N2为还原产物,CO2为氧化产物.
所以答案选B
本题难度:简单
5、填空题 洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为:______.
(2)漂白粉的有效成分是(填化学式)______.
(3)漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为______.
(4)反应(1)和反应(3)中,属于氧化还原反应的是(填编号)______.
参考答案:(1)氯气与碱反应生成金属氯化物和次氯酸盐,工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,氯气和石灰乳[Ca(OH)2]反应生成氯化钙和次氯酸钙以及水,方程式为:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,
故答案为:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;
(2)次氯酸盐是漂白杀毒剂的有效成分,漂白粉的有效成份是Ca(ClO)2,故答案为:Ca(ClO)2;
(3)漂白粉的漂白原理是:次氯酸钙与空气中的水和CO2作用生成的次氯酸是一种很好的杀菌消毒剂,反应方程式如下:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
(4)反应(1)中存在元素化合价的变化,反应(3)中没有元素化合价变化,所以(1)属于氧化还原反应,
故答案为:(1).
本题解析:
本题难度:一般