1、简答题 某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,A露置在空气中足够长时间变为C,B和酸性气体D?反应能生成C,A和B都能与水生成E,E和D也能生成C.回答下列问题.
(1)写出下列物质的化学式:C______,D______,E______.
(2)写出下列反应的化学方程式:①A和水生成E:______②B和D生成C:______.
参考答案:(1)银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,则B为Na2O2,,金属单质A为Na,露置在空气中足够长时间变为Na2CO3,
故答案为:Na2CO3;CO2;NaOH;
(2)①A和水生成E的反应为Na和水反应,生成NaOH,反应方程式为2Na+2H2O═2NaOH+H2↑,
故答案为:2Na+2H2O═2NaOH+H2↑;
②B和D生成C的反应为Na2O2和CO2反应,生成Na2CO3,反应方程式为2Na2O2+2CO2═2Na2CO3+O2,
故答案为:2Na2O2+2CO2═2Na2CO3+O2.
本题解析:
本题难度:一般
2、简答题 有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色.
请回答:
(1)若X与Z元素形成ZX2化合物,则ZX2的电子式______,其中含有的化学键有______.
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是______,此液体具有的性质是______(填写序号字母).
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼热后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体.
①已知一定条件下,每1mol该气体被O2完全氧化放热98.0kJ,写出该反应的热化学方程式______.若2mol该气体与1molO2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为______.
②原无色有刺激性气味的气体与含1.5mol?Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是______.
(4)Y的最高价氧化物对应水化物的化学式是______.
①常温下,将20mL0.1mol?L-1的该物质的水溶液与VmL0.1mol?L-1的氨水混合后pH=7,则V______20mL(填“>”“<”或“=”)
②常温下,将pH=2的该物质的水溶液V1mL与V2mL0.01mol?L-1的氨水混合后,溶液呈酸性,则V1与V2的关系满足______
A.V1>V2?B.V1<V2?C.V1=V2?D.无法确定
此时溶液中带电微粒的浓度大小顺序可能为______.
(5)Z的高价硝酸盐溶液中滴加足量HI溶液的离子方程式:______.
参考答案:有X、Y、Z三种元素;②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色.证明ZY3为FeCl3,①中X2-、Y-均与Y的气态氢化物分子具有相同的电子数为18电子微粒,X为S元素;推断XYZ元素分别为:S、Cl、Fe;
(1)若X与Z元素形成ZX2化合物,化学式为:FeS2,则FeS2的电子式为:
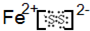
,其中含有的化学键有离子键和共价键;故答案为:
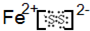
;共价键 离子键;
(2)将ZY3(FeCl3)溶液滴入沸水可得到红褐色液体为氢氧化铁胶体,反应的离子方程式是:Fe3++3H2O?加热?.?Fe(OH)3+3H+;故答案为:Fe3++3H2O?加热?.?Fe(OH)3+3H+;
a.光束通过该液体时形成光亮的“通路”是胶体的性质,发生了丁达尔现象,故a符合;
b.插入电极通直流电后,有一极附近液体颜色加深,是胶体的电泳性质,胶体微粒吸附带电荷离子,通电时移向某电极,氢氧化铁胶体微粒吸附带正电荷的离子,通电移向阴极,故b符合;
c.向该液体中加入硝酸银溶液,会出现白色沉淀产生,故c不符合;
d.将该液体加热聚沉生成沉淀、蒸干、灼热后,氢氧化铁分解生成氧化铁,有氧化物生成,故d符合;
故答案为:abd
(3)X单质为S在空气中燃烧生成一种无色有刺激性气味的气体生成为SO2,
①已知一定条件下,每1mol该气体被O2完全氧化放热98.0kJ,依据化学反应方程式写出该反应的热化学方程式:2SO2(g)+O2(g)=2 SO3(g);△H=-196kJ/mol;若2molSO2气体与1molO2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,因为反应是可逆反应,实际反应的二氧化硫气体物质的量=2×176196=1.8mol;为则该气体的转化率=1.8mol2mol×100%=90%;故答案为:2SO2(g)+O2(g)=2 SO3(g);△H=-196kJ/mol;90%;
②原无色有刺激性气味的气体SO2与含1.5mol Y的一种含氧酸,该酸的某盐常用于实验室制取氧气,判断为KClO3;含氧酸溶液为HClO3的溶液和二氧化硫气体一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,物质的量为1.5mol;依据电子守恒可知:设氯酸中氯元素化合价从+5价变化为x价
SO2~H2SO4~2e-
1? 2
0.75mol?1.5mol
HClO3~含氯的氧化物~(5-x)e-
1? 5-x
1.5mol? 1.5mol
得到x=4
所以氧化物化学式为ClO2;
所以的二氧化硫和氯酸物质的量之比为0.75:1.5=1:2;
反应的化学方程式是:SO2+2HClO3=H2SO4+2ClO2;
故答案为:SO2+2HClO3=H2SO4+2ClO2;
(4)Y为Cl元素的最高价氧化物对应水化物的化学式是:HClO4;
①常温下,将20mL0.1mol?L-1的HClO4的水溶液与VmL0.1mol?L-1的氨水,若恰好反应需要氨水20ml,生成NH4ClO4溶液是弱碱强酸盐水解显酸性,若混合后pH=7,说明氨水条件大于20ml;
②常温下,将pH=2的HClO4的水溶液V1mL与V2mL0.01mol?L-1的氨水混合后,溶液呈酸性,则V1与V2的关系满足V1≥V2时溶液一定呈酸性,若V1<V2,也可能呈酸性,所以不能确定,故选D.
此时溶液中带电微粒的浓度大小顺序可能为:恰好反应时溶液中离子浓度大小为:c(ClO4-)>c(NH4+)>c(H+)>c(OH-);酸过量溶液中离子浓度大小为:c(ClO4-)>c(H+)>c(NH4+)>c(OH-);?氨水稍过量溶液中离子浓度大小为:c(ClO4-)>c(NH4+)=c(H+)>c(OH-)
故答案为:HClO4 ;>;D;c(ClO4-)>c(NH4+)>c(H+)>c(OH-)或c(ClO4-)>c(H+)>c(NH4+)>c(OH-) 或 c(ClO4-)>c(NH4+)=c(H+)>c(OH-)
(5)Z为Fe,元素的高价硝酸盐溶液中滴加足量HI溶液反应三价铁离子和溶液中硝酸根离子在酸溶液中都具有氧化性都氧化碘离子,三价铁离子被还原为二价铁离子,硝酸钡还原为一氧化氮,碘离子被氧化为单质碘,依据原子守恒和单质守恒配平写出,反应的离子方程式:Fe3++3NO3-+12H++10I-=Fe2++5I2+3NO↑+6H2O;
故答案为:Fe3++3NO3-+12H++10I-=Fe2++5I2+3NO↑+6H2O;
本题解析:
本题难度:一般
3、填空题 (8分)下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)

请回答下列问题:
(1)物质A的化学式为__________。
(2)化合物E的电子式为__________。
(3)反应①的离子方程式为__________;反应②的化学方程式为__________。
参考答案:(1)Na2O2?(2)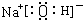
(3)2Na+2H2O=2Na++2OH—+H2↑;2NaHCO3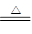 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
本题解析:最常见的无色液体是水,即B是水。A是由单质C在D中燃烧生成的淡黄色固体,所以A是过氧化钠,过氧化钠溶于水生成氧气和氢氧化钠,所以D是氧气,E是氢氧化钠,则C是钠,F是氢气。K为无色无刺激性气味的气体,且K能和氢氧化钠反应,所以K是CO2,H是碳酸钠,I是碳酸氢钠。
本题难度:一般
4、推断题 A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。

试回答:
(1)若X是强氧化性气体单质,则A可能是___________(填序号)。
a.C
b.Al
c.Na
d.Mg
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,X在A中燃烧产生棕黄色的烟, B的化学式为____________;C溶液在贮存时应加入少量X,理由是____________(用必要的文字和离子方程式表示) 。
② 向C的溶液中加入氢氧化钠溶液,现象是__________ ,写出涉及到的氧化还原反应的化学方程式 __________。
(3)若A、B、C均为含有同种金属元素的化合物, X是强酸或强碱,则B的化学式为________,反应②的离子方程式为___________ 或___________ 。
参考答案:(1)ac
(2)①FeCl3;2Fe3++Fe==3Fe2+,防止Fe2+被氧化成Fe3+
②产生白色沉淀,迅速变成灰绿色,最终变为红褐色沉淀;4Fe(OH)2+O2+2H2O==4Fe(OH)3。
(3)Al(OH)3;Al(OH)3+OH-==AlO2-+2H2O或Al(OH)3+3H+==Al3++3H2O。
本题解析:
本题难度:一般
5、推断题 甲、乙、丙、丁是原子序数不超过20的元素组成的物质(单质或化合物),且存在如下转化关系,甲+乙→丙+丁
回答下列问题:
(1)转化关系中所涉及的反应为非氧化还原反应,且乙为水时:
①丙为可燃性气体,分子的空间构型为直线形结构。写出实验室制备丙的化学方程式______________。

②若甲是由N和Cl元素组成的化合物,其分子结构模型如上图所示,丙具有漂白性。则甲中Cl元素的化合价是___________。
(2)转化关系中所涉及的反应为氧化还原反应,且乙为水时:
①若甲可用于防毒面具、潜艇等常用的供氧剂,写出发生反应的化学方程式是___________________
②若丙和丁都是可燃性气体,其中丙是丁业炼铁过程中的还原剂。写出甲+乙→丙+丁的化学方程式是
___________________
③若甲是由N和O元素组成的气态物质,呈红棕色。将3.36g Fe加到一定量丙溶液中,收集到1.12 L气体丁(已折算为标准状况),则反应的离子方程式是________________________ 。(用一个离子方程式表示)
参考答案:(1)①CaC2+2H2O→Ca(OH)2+HC CH↑;②+1
CH↑;②+1
(2)①2Na2O2+2H2O=4NaOH+O2↑;②C+H2O CO+H2;③6Fe+5NO3-+2OH-=3Fe3++3Fe2++5NO↑+10H2O
CO+H2;③6Fe+5NO3-+2OH-=3Fe3++3Fe2++5NO↑+10H2O
本题解析:
本题难度:一般