1、选择题 X、Y、Z、W四种短周期元素,原子序数依次增大.X原子的最外层上p电子数与s电子数相等;Y有两种常见的同素异形体,其中一种是很好的脱色剂和消毒剂;Z、W原子最外层电子数之和是X最外层电子数的2倍;这四种元素的电子层数之和为10.据此推断下列说法不正确的是( )
A.XY2所形成的晶体属于分子晶体,它可用作致冷剂
B.若W的单质是有毒气体,则Z和Y可形成含有非极性共价键的离子化合物
C.若W的单质是淡黄色固体,则X和W可形成含极性键的非极性分子
D.若W的一种单质为正四面体结构,则Z的最高价氧化物的水化物Z(OH)3是一种强碱
参考答案:A.XY2是二氧化碳,二氧化碳晶体属于分子晶体,它可用作致冷剂,故A正确;
B.若W的单质是有毒气体,则W是氯气,Z是Na,则Na和O可形成含有非极性共价键的离子化合物Na2O2,故B正确;
C.若W的单质是淡黄色固体,W为S元素,则C和S可形成含极性键的非极性分子CS2,故C正确;
D.若W的一种单质为正四面体结构,所以W是P元素,则Z是Al元素,Z的最高价氧化物的水化物Al(OH)3是一种弱碱,故D错误;
故选D.
本题解析:
本题难度:简单
2、选择题 几种短周期元素的原子半径及主要化合价见下表:
| 元素代号 | L | M | Q | R | T
原子半径/nm
0.160
0.143
0.102
0.089
0.074
主要化合价
+2
+3
+6、-2
+2
-2
|
下列叙述正确的是( )
A.L、M的单质与稀盐酸反应速率:M>L
B.R的氧化物对应的水化物可能具有两性
C.T的气态氢化物分子间存在氢键
D.L、Q形成的简单离子核外电子数相等
参考答案:L和R的化合价都为+2价,应为周期表第ⅡA族,根据半径关系可知R为Be,L为Mg;Q和T的化合价都有-2价,应为周期表第ⅥA族元素,Q的最高价为+6价,应为S元素,T无正价,应为O元素;M的化合价为+3价,应为周期表第ⅢA族元素,根据M原子半径大于Q小于L可知应和L同周期,为Al元素.
A.金属性Mg>Al,则Mg与酸反应越剧烈,则相同条件下单质与稀盐酸反应速率为L>M,故A错误;
B.R为Be,与Al位于周期表对角线位置,性质相似,Al的氧化物的水化物为两性氢氧化物,则Be的氧化物对应的水化物可能具有两性,故B正确;
C.氧元素电负性很强,冰、液态水中存在氢键,气态水中不存在氢键,故C错误;
D.Mg2+核外有10个电子,S2-核外有18个电子,二者核外电子数不同,故D错误.
故选:B.
本题解析:
本题难度:简单
3、选择题 第三周期元素X,它的原子核外最外层实现8电子稳定结构所需的电子数小于次外层和最内层的电子数之差,且等于最内层电子数的整数倍.下列说法正确的是( )
A.X元素最高价氧化物对应的水化物一定是强酸
B.X元素的氢化物的化学式一定为H2X
C.X元素在常温下稳定存在的氧化物一定能与烧碱反应
D.X的单质一定不是良好的半导体材料
参考答案:第三周期元素X,有3个电子层,次外层和最内层的电子数之差为8-2=6,它的原子核外最外层实现8电子稳定结构所需的电子数小于6,且等于最内层电子数的整数倍,则X元素原子核外最外层实现8电子稳定结构所需的电子数为2或4,若为2,则X为硫元素,符合题意;若为4,则X为硅元素,符合题意.
A、Si元素最高价氧化物对应的水化物是硅酸,酸性比碳酸弱,属于弱酸,故A错误;
B、Si元素的氢化物的化学式为SiH4等,具有和烃类似的物质,故B错误;
C、Si元素在常温下稳定存在的氧化物为二氧化硅,二氧化硅能与烧碱反应生成硅酸钠,三氧化硫、二氧化硫都能与烧碱反应,故C正确;
D、硅单质是良好的半导体材料,故D错误.
故选:C.
本题解析:
本题难度:一般
4、简答题 原子序数依次增大的主族元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.?回答下列问题:
(1)这四种元素中电负性最大的是______(填元素符号)、第一电离能最小的是______(填元素符号);
(2)C所在的主族元素气态氢化物中,沸点最低的是______(填化学式);
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体?结构如图所示,其原子的杂化类型为______;
(4)D的水合醋酸盐晶体局部结构如图,该晶体中含有的化学键是______;
①极性键?②非极性键?③配位键?④金属键
(5)某学生所做的有关D元素的实验流程如图:
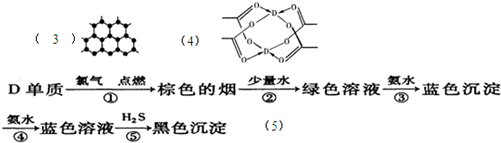
请书写第⑤反应的离子方程式:______.
参考答案:原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子,则A为氢元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为碳元素;B与C可形成正四面体型分子,则B为氯元素;D原子外围电子排布为3d104s1,则D为铜元素.
(1)氯元素非金属性最强,电负性越大;铜为金属,其它为非金属,所以铜第一电离能最小.
故答案为:Cl;Cu.
(2)HF中存在氢键,沸点比HCl高,其它氢化物相对分子质量越大,沸点越高,所以HCl的沸点最低.
故答案为:HCl.
(3)在其层状结构中碳碳键键角为120°,每个碳原子都结合着3个碳原子,碳原子采取sp2杂化,3个杂化轨道用来形成σ键结合其他碳原子,所有碳原子剩余2p轨道一同形成离域大π键.
故答案为:sp2.
(4)由结构图可知,该晶体中含有C-H键为极性键、C-C键为非极性键、配位键.
故选:①②③.
(5)由关系图可知,加氨水生成的蓝色沉淀为氢氧化铜,再加氨水生成的蓝色溶液为四氨合铜络离子,蓝色溶液通入硫化氢,生成硫化铜、铵根离子、一水合氨,
反应离子方程式为〔Cu(NH3)4〕2++H2S+2H2O=CuS↓+2NH4++2NH3?H2O.
故答案为:〔Cu(NH3)4〕2++H2S+2H2O=CuS↓+2NH4++2NH3?H2O.
本题解析:
本题难度:一般
5、选择题 下列原子构成的单质中,既能与稀硫酸反应又能与烧碱溶液反应,且都产生H2的是
[? ]
A.核内无中子的原子
B.最外层电子数等于倒数第三层上的电子数的原子
C.外围电子排布为3s23p1的原子
D.N层上无电子,最外层上的电子数等于电子层数的原子
参考答案:CD
本题解析:
本题难度:简单