1、选择题 标准状况下,若vL氢气含有的氢分子数为N,则阿伏加德罗常数可表示为
A.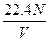 mol—1 B.
mol—1 B. mol—1 C.
mol—1 C. mol—1 D.
mol—1 D. mol—1
mol—1
参考答案:A
本题解析:略
本题难度:一般
2、选择题 用NA表示阿伏加德罗常数值,下列叙述正确的是
[? ]
A.17g氨气所含电子数目为10NA
B.标准状态下,1LSO3含有的分子数为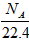
C.2.4g金属镁与足量的盐酸反应,转移电子数为2NA
D.在2L 1mol/L K2CO3溶液中,含有K+和CO32-的总数为6NA
参考答案:A
本题解析:
本题难度:简单
3、选择题 已知阿伏加德罗常数为NA,下列说法正确的是( )
A.实验室由过氧化钠制得1mol氧气转移的电子数是2NA
B.标况下22.4L的苯完全燃烧生成的CO2的体积是134.4L
C.1L0.1mol?L-1的氯水中含有的分子数小于0.1NA
D.1L0.5mol?L-1的Na2CO3溶液中含有的离子数目等于1.5NA
参考答案:A、用过氧化钠制氧气,氧原子由负一价变成0价,电子转移1个,每生成一个氧分子,转移电子2个,所以,制得1mol氧气转移的电子数是2NA,故A正确;
B、标况下,苯是液体,故B错误;
C、氯水的成分中是分子的有:H2O、Cl2、HClO,故C错误;
D、Na2CO3?是强碱弱酸盐,弱酸根离子发生水解,所以离子数小于1.5NA,故D错误.
故选A.
本题解析:
本题难度:一般
4、选择题 NA表示阿伏加德罗常数,下列判断正确的是
A.1?mol?Cl2参加反应转移电子数不一定为2?NA
B.60?g?SiO2晶体中含有2?NA个Si-O键
C.1?mol?Na2O2固体中含离子总数为4?NA
D.标准状况下,11.2?L乙醇中含有0.5?NA个分子
参考答案:A
本题解析:分析:A、氯气发生氧化还原反应可以只做氧化剂,也可以自身氧化还原反应;
B、质量换算物质的量,结合1个二氧化硅含有四个硅氧键;
C、过氧化钠由钠离子和过氧根离子构成;
D、标准状况乙醇不是气体;
解答:A、1mol氯气发生氧化还原反应可以只做氧化剂d得到电子2mol,也可以自身氧化还原反应转移电子为1mol,1 mol Cl2参加反应转移电子数不一定为2 NA,故A正确;
B、1个二氧化硅含有四个硅氧键,60 g SiO2晶体物质的量为1mol,结构中含有4NA个Si-O键,故B错误;
C、过氧化钠由钠离子和过氧根离子构成;1 mol Na2O2固体中含离子总数为3NA,故C错误;
D、标准状况乙醇不是气体,11.2 L乙醇中物质的量不是0.5mol,故D错误;
故选A.
点评:本题考查了阿伏伽德罗常数的应用,主要考查氧化还原反应的电子转移计算分析,质量换算物质的量计算化学键数,物质结构的判断,气体摩尔体积的条件应用,题目难度中等.
本题难度:简单
5、选择题 设NA为阿伏加德罗常数.下列叙述中正确的是( )
A.标准状况下,22.4?L?CO2和O2混合气体中含有的氧原子数约为NA
B.2?mol?SO2和1?molO2?混合在V2O5存在条件下的密闭容器中反应,反应后分子总数大于2?NA
C.常温常压下,0.1?mol铁在0.1?mol?Cl2中充分燃烧,转移的电子数为0.3?NA
D.1?L?1?mol/L的K2CO3溶液中离子总数小于3NA
参考答案:A、标准状况下,22.4?L?CO2和O2混合气体1mol,含氧原子2mol,故A错误;
B、2?mol?SO2和1?molO2?混合在V2O5存在条件下的密闭容器中反应,形成的是化学平衡,不能全部转化,所以反应后分子总数大于2?NA,故B正确;
C、0.1?mol铁在0.1?mol?Cl2中充分燃烧,依据反应2Fe+3Cl2=2FeCl3;铁过量,电子转移根据氯气计算,转移的电子数为0.2?NA,故C错误;
D、酸根离子水解会增多阴离子,1?L?1?mol/L的K2CO3溶液中离子总数大于3NA,故D错误;
故选B.
本题解析:
本题难度:简单