1、实验题 某同学利用下图所示的实验装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
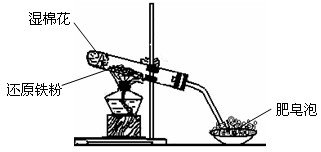
请回答下列问题。
(1)硬质试管中发生反应的化学方程式为___________________________________。
(2)该同学欲确定反应后硬质试管中固体物质的成分,设计了如下实验方案:
①待硬质试管冷却后,取少许其中的固体物质溶于稀硫酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红色则说明硬质试管中固体物质的成分是_____________,若溶液未变红色则说明硬质试管中固体物质的成分是_____________。
(3)该同学按上述实验方案进行了实验,结果溶液未变红色,原因是________________________(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按下图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关的反应的化学方程式__________________________。
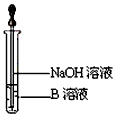
(5)一段时间后,该同学发现(3)中未变红的溶液变成红色,说明Fe2+具有________性。由此可知,实验室中含Fe2+的盐溶液现用现配制的原因是_____________,并且配制含Fe2+的盐溶液时应加入少量
________________________。
参考答案:(1)3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
(2)一定有Fe3O4,可能有Fe;Fe3O4和Fe
(3)Fe+2Fe3+=3Fe2+
(4)FeSO4+2NaOH=Fe(OH)2↓+ Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3
(5)还原;Fe2+易被空气中的氧气氧化而变质;铁粉
本题解析:
本题难度:一般
2、实验题 (10分)丁烷的催化裂解可按下列两种方式进行:C4H10 →C2H6 + C2H4;C4H10 → CH4 + C3H6;化学兴趣小组的同学为探究丁烷裂解气中CH4和 C2H6的比例关系,设计实验装置如下图所示
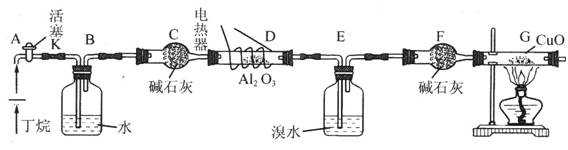 注:CuO能将烃氧化成CO2和H2O;后面的装置已略去。
注:CuO能将烃氧化成CO2和H2O;后面的装置已略去。
请回答下列问题:
(1)如图连接好装置后,需进行的实验操作有①给D、G装置加热;②检查整套装置的气密性;③排尽装置中的空气。这三步操作的先后顺序依次是?,
简要说明排空气和证明空气已排尽的方法?。
(2)为了调控实验过程中丁烷的气流速度,设置了B装置,操作时应观察?来实现实验的要求。
(3)若对E装置中的混合物再按以下流程实验:
 分离操作I和II的操作名称分别是:I?,II?。
分离操作I和II的操作名称分别是:I?,II?。
(4)假设丁烷完全裂解,且流经各装置中的气体均完全反应,为测定丁烷裂解产物中n(CH4):n(C2H6)的值,本实验中应该准确获取的数据应有?(选填下列数据序号)。
① C装置增加的质量?② E装置增加的质量?③ F装置增加的质量?④ G装置增加的质量
参考答案:(1)?(2)(3)(1)? 2分?打开活塞K通入丁烷气体排出装置中空气(1分),用一小试管收集从G装置右端导管口流出的气体,点燃检验其纯度(1分)
(2)气泡的逸出速度? 2分
(3)分液?蒸馏?每空2分
(4)(2)(3)(4) 2分,少选一个得1分,错选不得分
本题解析:略
本题难度:一般
3、填空题 (14分)某兴趣小组的学生根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧,为了确定其生成产物并进行实验论证。某同学设计了下图所示装置进行实验(已知PdCl2能被CO还原得到黑色的Pd),请回答下列问题:
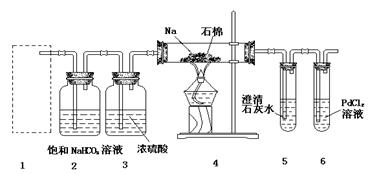
(1)为使反应随开随用,随关随停,方框内应选用下图所示?装置(填字母代号)。
(2)实验室制取二氧化碳气体宜用的药品是?(填标号)。
①石灰石,②纯碱,③小苏打,④18.4 mol·L—1硫酸,⑤11.2mol·L—1盐酸,⑥蒸馏水,⑦木炭粉。
(3)在2装置内进行反应的离子方程式为?。检查装置气密性并装好药品后,点燃酒精灯之前待装置?(填数字编号)中出现?现象时,再点燃酒精灯。
(4)①若装置6中有黑色沉淀,装置4中残留固体(只有一种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为?;
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸后有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为?。
参考答案:(1)C(2分)。(2)①⑤⑥(2分)。
(3)HCO3-+H+ =CO2↑+ H2O(2分),5(1分),白色浑浊(1分)。
=CO2↑+ H2O(2分),5(1分),白色浑浊(1分)。
(4)2CO2+2Na= Na2CO3+CO(3分),3CO2+4Na= 2Na2CO3+C
(条件写成 “加热”或“点燃”均正确)(3分),
“加热”或“点燃”均正确)(3分),
本题解析:略
本题难度:简单
4、简答题 肉桂酸主要用于制备酯类,还用作植物生长促进剂、长效杀菌剂.苯甲醛和乙酸酐在碱性催化剂(如无水K2CO3)作用下,生成肉桂酸,方程式如下:
C6H5CHO+(CH3CO)2O?C6H5CH=CHCOOH+CH3COOH
有关数据如下表:
| 物质 | (CH3CO)2O | C6H5CHO | C6H5CH=CHCOOH | CH3COOH
沸点
139℃
179℃
300℃
117.9℃
|
实验室制取肉桂酸的步骤如下:
①在250mL三颈烧瓶中,加入7g无水K2CO3,5mL苯甲醛和14mL醋酸酐,电热套加热(或用油浴加热)回流45min(如图一,冷凝管可不通冷凝水).
②稍冷后,加入20mL水,缓慢加入适量固体碳酸钠,使溶液呈微碱性.进行水蒸气蒸馏(如图二),直到无油状物蒸出为止.
③水蒸气蒸馏残留液加入少量活性炭,煮沸数分钟趁热过滤,在搅拌下往热滤液中加入浓盐酸至呈酸性.
④冷却,过滤,用少量冷水洗涤产物,产物在空气中晾干,称重,计算产率.

回答下列问题:
(1)在肉桂酸的制备中,水蒸气蒸馏的目的是______.
(2)在肉桂酸制备实验中,为什么要缓慢加入固体碳酸钠来调节pH值?______.
(3)用少量冷水洗涤产物的目的:______.
(4)在浓强碱存在下,C6H5CHO发生反应:2C6H5CHO+KOH(浓)→C6H5COOK+C6H5CH2OH反应类型为:______.
(5)写出苯甲醛和丙酸酐[(CH3CH2CO)2O]在无水K2CO3存在下,发生的反应的化学方程式:______.
参考答案:(1)由于水蒸气蒸馏使有机物可在较低的温度下从混合物中蒸馏出来,可以避免在常压下蒸馏时所造成的损失,提高分离提纯的效率.同时在操作和装置方面也较减压蒸馏简便一些,所以水蒸气蒸馏可以应用于分离和提纯有机物,
故答案为:为了蒸出苯甲醛;
(2)在肉桂酸制备实验中,缓慢加入固体碳酸钠,可以减小二氧化碳产生速率,有利于调节PH,所以缓慢加入固体碳酸钠来调节pH值原因是:若加入碳酸钠的速度过快,易产生大量CO2的气泡,而且不利于准确调节pH值,
故答案为:若加入碳酸钠的速度过快,易产生大量CO2的气泡,而且不利于准确调节pH值;
(3)由于洗涤是为了洗去固体表面的杂质,冷水中固体溶解度减小,可以减少固体损失,
故答案为:提纯,洗去固体表面的杂质离子,同时用冷水是为了减少固体因溶解带来的损失;
(4)2C6H5CHO+KOH(浓)→C6H5COOK+C6H5CH2OH反应中,醛基被氧化成了羧基,同时醛基被还原成醇羟基,属于氧化还原反应,
故答案为:氧化还原反应;
(5)根据反应C6H5CHO+(CH3CO)2O?C6H5CH=CHCOOH+CH3COOH,苯甲醛和丙酸酐[(CH3CH2CO)2O]在无水K2CO3存在下反应方程式为: ,
,
故答案为: .
.
本题解析:
本题难度:一般
5、选择题 中和滴定是一种操作简单,准确度高的定量分析方法。实际工作中也可利用物质间的氧化还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点,下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时的溶液颜色的判断不正确的是( )
A.用标准酸性KMnO4溶液滴定Na2SO3溶液以测量其浓度:KMnO4——紫红色
B.利用“Ag++SCN-===AgSCN↓”原理,可用标准KSCN溶液测量AgNO3溶液浓度:Fe(NO3)3——红色
C.利用“2Fe3++2I-===I2+2Fe2+”, 用FeCl3溶液测量KI样品中KI的百分含量:
用FeCl3溶液测量KI样品中KI的百分含量:
淀粉——蓝色
D.利用OH-+H+===H2O来测量某盐酸溶液的浓度时:酚酞——浅红色
参考答案:C
本题解析:略
本题难度:一般