1、选择题 将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应2A(g)+B(g)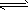 2C(g), 若经2s后测得C的浓度为0.6mo1·L-1,现有下列几种说法:
2C(g), 若经2s后测得C的浓度为0.6mo1·L-1,现有下列几种说法:
① 用物质A表示的反应的平均速率为0.3mol·L-1·s-1
② 用物质B表示的反应的平均速率为0.6mol·L-1·s-1
③ 2s时物质A的转化率为70%
④ 2s时物质B的浓度为0.7mo1·L-1
其中正确的是
[? ]
A.①③
B.①④
C.②③
D.③④
参考答案:B
本题解析:
本题难度:简单
2、填空题 在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如右图,据图回答下列问题:
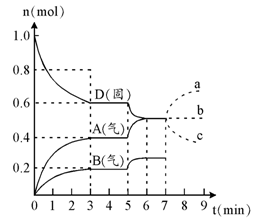
1、从反应开始到第一次达到平衡时,A物质的平均反应速率为?mol/L·min。
2、根据右图写出该反应的化学方程式?,该反应的平衡常数表达式为K =??。
3、第5分钟时,升高温度,A、B、D的物质的量变化如右图,则该反应的正反应是?(填“放热”或“吸热”)反应,反应的平衡常数?(填“增大”、“减小”或“不变”。下同),B的反应速率??。
4、若在第7分钟时增加D的物质的量,A的物质的量变化正确的是?(用图中a、b、c的编号回答)
参考答案:1、0.067?(1分)
2、2D(s) ?2A(g)+ B(g)?(2分)、c(A)2×c)B)?(1分)
?2A(g)+ B(g)?(2分)、c(A)2×c)B)?(1分)
3、吸热(1分)、?增大(1分)、?增大?(1分)
4、b?(1分)
本题解析:
(1) 0.067 mol/L·min
0.067 mol/L·min
(2)由图示可看出,在反应开始到达平衡三物质的:△n:? 0.4? 0.4? 0.2,则化学方程式为:2D(s) ?2A(g)+ B(g),K=c(A)2×c)B)
?2A(g)+ B(g),K=c(A)2×c)B)
(3)升温后AB的量增大,说明平衡正向移动,则正反应为吸热反应,平衡常数增大,各物质的反应速率增大
(4)D非气态,所以改变它的量,不会对反应速率产生影响,所以平衡也不会移动,各物质的量保持不变,故答案为b
本题难度:一般
3、计算题 (8分)在一定温度下的5L的密闭固定容积容器中,通入10molNH3,发生了如下反应:N2+3H2 2NH3,反应进行到2min时,测得容器内有2molN2,求:
2NH3,反应进行到2min时,测得容器内有2molN2,求:
(1)2min时的N2的浓度?(2)2min内的平均速率υ(NH3)?
(3)反应前后容器中气体压强之比?(4)NH3的分解率?
参考答案:0.4? 0.4? 5:7? 40%
本题解析:略
本题难度:一般
4、选择题 2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:
PCl3(g)+Cl2(g)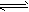 PCl5(g)达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是
PCl5(g)达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是
[? ]
A.0.40mol
B.0.20mol
C.小于0.20mol
D.大于0.20mol,小于0.40mol
参考答案:C
本题解析:
本题难度:一般
5、计算题 (8分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2(g)+3H2(g) 2NH3(g)(注:要求每步均要写出计算过程)
2NH3(g)(注:要求每步均要写出计算过程)
(1)若反应进行到某时刻t时,nt(N2)="6.5" mol,nt(NH3)="3" mol,计算a的值。
(2)反应达平衡时,混合气体的体积为358.4 L(标况下) ,其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的
,其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的 量。
量。
(3)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)等于多少?
参考答案:(1) a=8。(2)n (NH3)=" 4" mol(3分)(3) 3∶3∶2(3分)
本题解析:(1)解法一:由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1∶2,设反应掉N2的物质的量为x mol。则x∶6=1∶2?解之x=3 ?a=6.5+1.5=8。
解法二:? N2?+3H2 2NH3
2NH3
开始时:a? b? 0
转化? 1.5? 4.5? 3
t时:?6.5 ? 3
3
在t时生成3 mol NH3,消耗了1.5 mol N2,所以a=6.5+1.5=8(3分)
(2)n (NH3)="(358.4L/22.4L/mol)×25%=16" mol×25%="4" mol(3分)
(3) 3∶3∶2(3分)
本题难度:一般