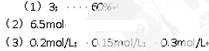
1、填空题 一定温度下在10L容器中加入5molSO2和3molO2,当反应达到平衡时,有3molSO2发生了反应,则:
(1)生成了_________molSO3,SO2的转化率为_________(用百分数表示)。
(2)平衡时容器内气体的总物质的量为_________。
(3)平衡时SO2的浓度是_________ ,O2的浓度是_________,SO3的浓度是_________ 。
参考答案:
本题解析:略
本题难度:一般
2、选择题 将气体A、B置于容积为2L的密闭容器中,发生如下反应:4A(g)十B(g)=2C(g)反应进行到4s末,测得A为0.5mol,B为0.4mol,C为0.2mol。则用反应物A浓度的减少来表示该反应的速率应为
[? ]
A.0.025 mol/(L·s)
B.0.0125 mol/(L·s)
C.0.05 mol/(L·s)
D.0.1 mol/(L·s)
参考答案:C
本题解析:
本题难度:简单
3、选择题 已知4NH3+5O2=4NO+6H2O,若反应速度分别用V(O2)、V(NH3)、V(NO)、V(H2O) (mol·Lˉ1·minˉ1)。则正确的关系是
A.4/5V(NH3)=V(O2)
B.5/6V(O2)=V(H2O)
C.2/3V(NH3)=V(H2O)
D.4/5V(O2)=V(NO)
参考答案:D
本题解析:试题分析:同一反应中,反应速率之比是相应的化学计量数之比,所以根据反应的化学方程式可知,选项D正确,其余选项都是错误的,答案选D。
考点:考查反应速率的计算和判断
点评:该题是基础性试题的考查,试题基础性强,主要是考查学生对反应速率与化学计量数关系的了解掌握程度,难度不大。该题的关键是明确反应速率的含义,特别是反应速率与化学计量数的关系,然后结合具体的化学方程式、具体分析即可。
本题难度:简单
4、选择题 在一定温度下,饱和氯水中存在平衡:Cl2+H2O H++Cl-+HClO。下列说法中确的是
H++Cl-+HClO。下列说法中确的是
A.光照一段时间后,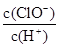 增大
增大
B.加入碳酸钙粉末后,溶液的pH增大
C.加入少量水,由水电离的c(H+)减小
D.加入NaOH固体,一定有c(Na+)>c(Cl-)>c(H+)>c(ClO-))
参考答案:B
本题解析:A、次氯酸不稳定,光照HClO易分解生成HCl和氧气,所以溶液中c(ClO-)降低,c(H+)增大,因此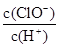 减小,故A错误;B、碳酸的酸性强于次氯酸的,所以碳酸钙与次氯酸不反应,而与盐酸反应,虽然平衡向正反应移动,但溶液中c(H+)仍然是减小的,因此溶液的pH增大,故B正确;C、稀释溶液,溶液中c(H+)减小,c(OH-)浓度增大,溶液中OH-的浓度等于水电离的H+的浓度,因此水电离的c(H+)增大,故C错误;D、如果加入过量的氢氧化钠,则溶液中c(ClO-)远远大于c(H+),故D错误,答案选B。
减小,故A错误;B、碳酸的酸性强于次氯酸的,所以碳酸钙与次氯酸不反应,而与盐酸反应,虽然平衡向正反应移动,但溶液中c(H+)仍然是减小的,因此溶液的pH增大,故B正确;C、稀释溶液,溶液中c(H+)减小,c(OH-)浓度增大,溶液中OH-的浓度等于水电离的H+的浓度,因此水电离的c(H+)增大,故C错误;D、如果加入过量的氢氧化钠,则溶液中c(ClO-)远远大于c(H+),故D错误,答案选B。
本题难度:一般
5、选择题 为了探索外界条件对反应:aX(g)+bY(g)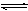 cZ(g) 的影响,将X和Y以物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是(?)
cZ(g) 的影响,将X和Y以物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。 下列判断正确的是(?)
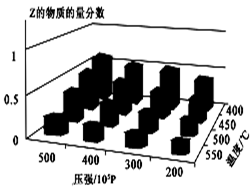
A.△H<0, a+b>c
B.△H>0, a+b<c
C.△H>0, a+b>c
D.△H<0, a+b<c
参考答案:A
本题解析:根据图像可知,在压强相等时,温度越高,Z的含量越低。这说明升高温度,平衡向逆反应方向移动,因此正反应是放热反应,即△H<0;当温度相等时,压强越大,Z的含量越高。这说明增大压强,平衡向正反应方向移动,因此正反应是体积减小的可逆反应,即a+b>c,答案选A。
考查:考查外界条件对平衡状态的影响、图像识别等
本题难度:一般