Ⅰ对、Ⅱ对、有
参考答案:D
本题解析:A中陈述Ⅰ用锌和足量稀硫酸制取氢气时加入硫酸铜溶液,是形成锌铜原电池,加快反应速率,但是制取的氢气会减少,因为其中一部分锌用来置换出铜,所以Ⅰ对、Ⅱ错、两者间无因果关系;B中陈述Ⅰ用Mg—Al—NaOH构成原电池由于镁不能和氢氧化钠反应,铝可以,所以镁做正极;所以Ⅰ对、Ⅱ错、两者间无因果关系;C中陈述ⅠAlCl3是离子化合物本身就是错误的,因为它是共价化合物,所以也无法电解熔融的氯化铝,所以Ⅰ错、Ⅱ错、两者间无因果关系;D中陈述Ⅰ石墨常用做电解池的电极,陈述Ⅱ石墨的化学性质稳定且导电性好,所以Ⅰ对、Ⅱ对、两者间有因果关系。故选D。
点评:本题考查的是原电池的应用。学生要熟练掌握原电池的基本知识,这类问题便可解决。原电池是将化学能直接转化为电能的一种装置。其原理也是通过化学反应(在正负极发生不同的氧化还原反应)使闭合电路中产生电子流,从而产生电流的。其中在负极发生氧化反应,正极发生还原反应。
本题难度:一般
2、选择题 下列拟采用的金属防腐措施,错误的是
A.给金属衣架或电线外面包上一层塑料层
B.给自行车钢圈镀上一层金属铬
C.在轮船的外表面焊上一些铜块
D.给铁栅栏表面涂上一层油漆?
参考答案:C
本题解析: A、给金属衣架或电线外面包上一层塑料层,可以使金属与空气和水隔离,房子腐蚀,错误;B、金属铬具有很高的耐腐蚀性,在空气中,即便是在赤热的状态下,氧化也很慢。不溶于水,镀在金属上可起保护作用,错误;C、起不到防腐蚀的作用,正确;D、隔绝空气和水,可以防腐蚀,错误。
本题难度:简单
3、选择题 下列有关钢铁腐蚀与防护的说法正确的是?
[? ]
A.?钢管与电源正极连接,钢管可被保护 ?
B.?铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 ?
C.?钢管与铜管露天堆放在一起时,钢管不易被腐蚀 ?
D.?钢铁发生析氢腐蚀时,负极反应是Fe-3e-=Fe3+
参考答案:B
本题解析:
本题难度:一般
4、选择题 2008年,美籍华裔化学家钱永健获得该年度诺贝尔化学奖。少年时代,他就对化学产生了浓厚的兴趣。
16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获具有“少年诺贝尔奖”之称的著名奖项。下列说法正确的是
[? ]
A.金属腐蚀就是金属原子失去电子被还原的过程
B.合金都比纯金属易被腐蚀
C.将金属与外加直流电源的负极相连,而将正极接到废铁上,可以防止金属被腐蚀
D.镀锌铁比镀锡铁更容易被腐蚀
参考答案:C
本题解析:
本题难度:简单
5、填空题 (8分)根据下边的实验装置图回答下列问题。
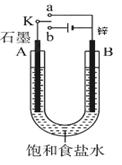
(1)若开始时开关K与a连接,则B极的电极反应式为?;?
(2)若开始时开关K与b连接,则B极的电极反应式为?;?
总反应的化学方程式为??;?
有关上述实验,下列说法正确的是(填序号)?。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
参考答案:(1) Zn-2e-=Zn2+? (2)2H++2e-=H2↑? 2NaCl+2H2O Cl2↑+H2↑+2NaOH?②④ Cl2↑+H2↑+2NaOH?②④
本题解析:(1)若开始时开关K与a连接,则构成原电池,锌是活泼的金属,所以锌是负极,石墨是正极。其中负极方程式是Zn-2e-=Zn2+。
(2)若开始时开关K与b连接,则构成电解池。B电极和电源的负极相连,作阴极,溶液中的氢离子放电,方程式是2H++2e-=H2↑;阳极是石墨,溶液中的氯离子放电,所以总的反应式是2NaCl+2H2O Cl2↑+H2↑+2NaOH;电解池中阳离子向阴极移动,①不正确;氯气具有氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,②正确;电解中生成的是氢气和氯气,所以要恢复到电解前的状态,应该是通入氯化氢气体,③不正确;氢气是2.24L,在标准状况下是0.1mol,所以转移电子是0.2mol,④正确,答案选②④。 Cl2↑+H2↑+2NaOH;电解池中阳离子向阴极移动,①不正确;氯气具有氧化性,能把碘化钾氧化生成单质碘,碘遇淀粉显蓝色,②正确;电解中生成的是氢气和氯气,所以要恢复到电解前的状态,应该是通入氯化氢气体,③不正确;氢气是2.24L,在标准状况下是0.1mol,所以转移电子是0.2mol,④正确,答案选②④。
本题难度:一般
|