1、选择题 当周围空间不慎有大量氯气溢出时,处在该环境中的人可以用浸有一定浓度某种物质的水溶液的毛巾捂住鼻子,以防中毒,最适宜采用的物质是
A.NaOH
B.KI
C.NH3?H2O
D.Na2CO3
参考答案:D
本题解析:
本题难度:简单
2、选择题 金属K与Na金属性相近,用金属K与钠盐共熔时,很难将Na从混合物中分离。若调整温度到一定程度,则可用Na与KCl反应制取金属K。已知四种物质的熔沸点如下:
A.97.8 ℃~770℃
B.770℃~774℃
C.774℃~882.9℃
D.1413℃~1500℃
参考答案:C
本题解析:(热还原冶炼法)金属活动顺序表中,Na排在钾的后面,似乎不能从钾的熔盐中置换出K。但将Na与KCl共熔,其共熔体中Na+、K+、Cl-和e-自由移动;如果继续加热,则Na、K、NaCl和KCl首先沸腾者逸出无疑。工业上,就是采用这种原理用Na还原K的,因为K的沸点比Na、NaCl、KCl的沸点都低,且高于Na、NaCl、KCl的熔点。
本题难度:一般
3、选择题 下述实验不能达到预期实验目的是
A.A
B.B
C.C
D.D
参考答案:D
本题解析:分析:A.从难溶电解质的溶解平衡的角度分析;
B.甲苯可与酸性高锰酸钾反应;
C.根据反应现象判断能否反应;
D.应在碱性条件下反应.
解答:A.再向其中滴加0.1mol/LNa2S溶液,会生成黑色沉淀,说明有Ag2S生成,可说明Ag2S的溶解性更小,故A正确;
B.甲苯可与酸性高锰酸钾反应生成苯甲酸,而苯不反应,说明与苯环相连的甲基易被氧化,故B正确;
C.二氧化碳与水反应生成碳酸,向Na2SiO3溶液中通入CO2产生沉淀,可说明碳酸的酸性比硅酸强,故C正确;
D.淀粉在酸性条件下水解生成葡萄糖,与氢氧化铜的反应应在碱性条件下进行,应先调节溶液至碱性,故D错误.
故选D.
点评:本题考查化学实验方案的评价,题目难度中等,注意实验的原理和合理性,把握相关物质的性质是解答该题关键.
本题难度:一般
4、选择题 丙烯和丙醇组成的混合物中氧的质量分数为
A.14%
B.22%
C.78%
D.13%
参考答案:ABD
本题解析:分析:丙烯的化学式为C3H6,丙醇的化学式为C3H8O,利用极限法计算.
解答:丙烯的化学式为C3H6,丙醇的化学式为C3H8O,如果只有丙烯,那么氧的质量分数为0,如果全是丙醇,那么氧的质量分数为 100%=26.7%,
100%=26.7%,
则混合物中氧的质量分数介于0~26.7%之间,
故选ABD.
点评:本题考查混合物的计算,题目难度不大,注意根据各物质的中氧的含量用极限法求解.
本题难度:困难
5、选择题 将2.8克Fe在一定量稀硝酸中恰好完全溶解后,往溶液中滴加NaOH?溶液立即产生沉淀,滴加至沉淀量最大时,再将所得溶液和沉淀一起加热蒸干,并在空气中灼烧至恒重,所得固体成分和可能的质量为
A.FeO 3.6g? NaNO3 12.75g
B.Fe2O3 4g? NaNO2 6.9g
C.Fe3O4 3.87g? NaNO3 10.25g
D.Fe2O3 4g? NaNO2 9.8g
参考答案:BD
本题解析:分析:根据2.8g Fe与稀硝酸反应可能生成硝酸亚铁或硝酸铁两种情况计算,2.8g Fe的物质的量为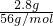 =0.05mol,加入氢氧化钠后蒸干,得到0.05mol氢氧化铁(氢氧化亚铁会被空气氧化)和0.1mol硝酸钠,或硝酸钠0.15mol,最后得到0.025mol氧化铁和0.1mol硝酸钠或0.15mol亚硝酸钠,可分别计算出亚硝酸钠的质量范围.
=0.05mol,加入氢氧化钠后蒸干,得到0.05mol氢氧化铁(氢氧化亚铁会被空气氧化)和0.1mol硝酸钠,或硝酸钠0.15mol,最后得到0.025mol氧化铁和0.1mol硝酸钠或0.15mol亚硝酸钠,可分别计算出亚硝酸钠的质量范围.
解答:如果2.8gFe的物质的量为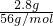 =0.05mol铁全部恰好生成硝酸亚铁,
=0.05mol铁全部恰好生成硝酸亚铁,
则硝酸亚铁物质的量为0.05mol,加入氢氧化钠后蒸干,
得到0.05mol氢氧化铁(氢氧化亚铁会被空气氧化)和0.1mol硝酸钠,
根据元素质量守恒可得加热生成0.025mol氧化铁和0.1mol亚硝酸钠,
质量是:氧化铁0.025mol×160g/mol=4g,亚硝酸钠0.1mol×69g/mol=6.9g
如果恰好生成硝酸铁0.05mol,则氧化铁依然是0.025mol,硝酸钠是0.15mol,
灼烧有氧化铁4g,根据Na元素守恒可得亚硝酸钠0.15mol,质量为0.15mol×69g/mol=10.35g
所以氧化铁质量肯定是4g,亚硝酸钠质量应该在[6.9,10.35]区间内.
故选BD.
点评:本题考查混合物的计算,题目难度较大,注意本题考虑2.8gFe与稀硝酸反应可能生成硝酸亚铁或硝酸铁两种情况计算,利用端值法求解.
本题难度:困难